Caso clínico
Quispe López N, Dahdouh M, Ledesma Sánchez L, Rodríguez Muñoz P. Manejo quirúrgico y restaurador de un implante en área estética y evaluación volumétrica tras un injerto de tejido conectivo desepitelizado. Descripción de un caso clínico. Cient. Dent. 2024; 21; 2; 75-82.
Manejo quirúrgico y restaurador de un implante en área estética y evaluación volumétrica tras un injerto de tejido conectivo desepitelizado. Descripción de un caso clínico
Introducción (fundamento y objetivos): Tras la extracción de un diente se producen cambios en los tejidos blandos asociados a la reabsorción ósea en sentido vertical y horizontal. Este colapso se puede abordar mediante injertos de hueso e injertos de tejido conectivo. El objetivo de este caso clínico es describir la secuencia de tratamiento llevada a cabo desde la extracción hasta la entrega de la corona definitiva, combinando conceptos regenerativos, cirugía guiada, mucogingivales y protésicos. Además, se describe y analiza mediante un software de análisis digital las modificaciones de espesor mucoso vestibular ocurridas tras el uso de un injerto de tejido conectivo.
Métodos: La secuencia quirúrgica consistió en realizar una preservación alveolar. Tras 4 meses, se planificó y colocó un implante guiado en posición 1.2 con injerto de tejido conectivo simultaneo. Tras su integración, se acondicionaron los tejidos blandos con una corona provisional y luego, se colocó la restauración atornillada definitiva.
Resultados: El enfoque de colocación guiado del implante y la aplicación de un injerto de tejido conectivo mostraron resultados estéticos y ganancias volumétricas de tejido blando significativas.
Conclusiones: El manejo minucioso de los tejidos duros y blandos, así como la planificación mediante cirugía guiada aumenta la precisión en relación con la posición ideal del implante, lo que repercutirá en la estabilidad a largo plazo de tejidos duros y blandos.
Surgical and restorative management of a dental implant in the esthetic zone and volumetric evaluation following depithelized connective tissue graft: a case report
Introduction (basis and objectives): After tooth extraction, changes occur in the soft tissues associated with bone resorption in a vertical and horizontal direction. This collapse can be addressed through bone grafts and connective tissue grafts. The objective of this clinical case is to describe the treatment sequence carried out from extraction to delivery of the definitive crown, combining regenerative, guided surgery, mucogingival and prosthetic concepts. Furthermore, changes in vestibular mucosal thickness that occurred after the use of a connective tissue graft are described and analyzed using digital analysis software.
Methods: The surgical sequence consisted of performing alveolar preservation. After 4 months, a guided implant was planned and placed in position 1.2 with simultaneous connective tissue graft. After integration, the soft tissues were conditioned with a provisional crown and then the definitive screw-retained restoration was placed.
Results: The guided implant placement approach and application of a connective tissue graft showed aesthetic results and significant soft tissue volumetric gains.
Conclusions: Careful management of hard and soft tissues, as well as planning through guided surgery, increases precision regarding the ideal position of the implant, which will impact the long-term stability of hard and soft tissues.
Keywords: Surgery; Computer-Assisted; Dental implants; Soft tissue; Connective tissue; Software tool.
En el campo de la implantología, la tecnología digital ha surgido como un avance para mejorar los procedimientos quirúrgicos y conseguir tratamientos de alta calidad ofreciendo resultados estéticos. En este contexto, la cirugía guiada, introducida en los años noventa, se considera como una práctica dental contemporánea que se basa en una planificación digital y el uso de tecnologías de imagen avanzadas1. La colocación de implantes se realiza mediante el uso de guías quirúrgicas impresas en 3D y un kit específico diseñado para cada sistema2. Comparada con la técnica convencional, un implante guiado ha demostrado optimizar de manera considerable la seguridad, minimizar la lesión de estructuras anatómicas adyacentes y reducir el tiempo quirúrgico y la morbilidad intra y postoperatoria3–5. Sin embargo, la cirugía guiada requiere una inversión financiera, una planificación anticipada más minuciosa y precisa y un profesional de experiencia más amplia para su manejo adecuado2,6.
No hay duda de que el resultado estético del tratamiento con implantes en el área anterior maxilar es de gran importancia. Para ello, es esencial contar con un soporte adecuado de tejido periimplantario, abarcando tanto los tejidos duros como los blandos. Cada profesional debe asumir la responsabilidad de mejorar el fenotipo de los tejidos blandos periimplantarios, enfocándose en tres componentes principales: espesor gingival , ancho de mucosa queratinizada y altura del tejido supracrestal7,8. Trabajos de investigación actuales consagran a los procedimientos de aumento de tejido blando como intervenciones esenciales. No solo aumentan la estabilidad a nivel óseo, sino que también controlan los signos inflamatorios y previenen complicaciones estéticas futuras 7,9–11.
En la última década, la evaluación cuantitativa de los tejidos aumentados se ha basado principalmente en métodos clínicos como son la sonda periodontal y las limas endodónticas. No obstante, los instrumentos analógicos utilizados carecen de precisión tridimensional para la evaluación correcta de los cambios volumétricos12. Por tanto, el uso de tecnologías digitales como la tomografía computarizada, ecografía y el análisis tridimensional de archivos STL (Standard Tessellation Language) derivados de la digitalización de modelos de yeso o el escaneo intraoral resulta beneficioso13–15. Estas herramientas digitales y computarizadas ofrecen ventajas significativas en el diagnóstico, planificación y tratamiento odontológico. Así pues, proporcionan mediciones no invasivas y cómodas para los pacientes, mayor precisión en evaluaciones 2D y 3D (alcanzan una precisión de 0,01 mm) y permiten realizar un seguimiento a largo plazo analizando las modificaciones ocurridas en los tejidos16,17.
El objetivo de este caso clínico es presentar una secuencia de tratamiento en una situación clínica donde las circunstancias anatómicas y restauradoras no permitieron la colocación de un implante inmediato en el sector estético. Y, además, describir y evaluar mediante una técnica no invasiva y un software de análisis tridimensional, los cambios volumétricos del tejido blando tras la colocación de un injerto de tejido conectivo en vestibular y oclusal del implante.
1.1. Diagnóstico y plan de tratamiento
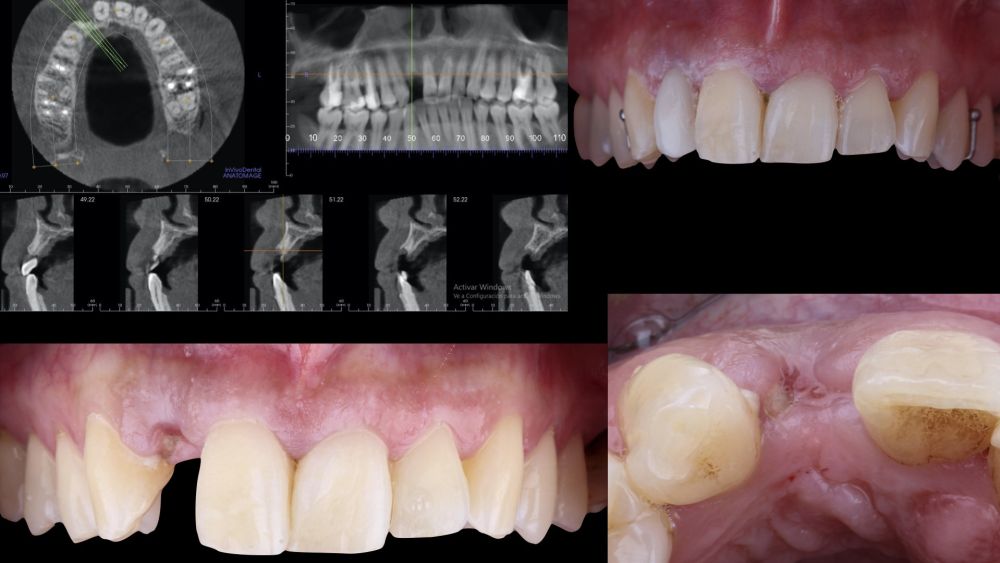
Una mujer de 29 años acudió a nuestra clínica dental tras sufrir un traumatismo en el incisivo lateral superior derecho (1.2). Tras el traumatismo, el diente sufrió una fractura de toda la corona anatómica, por lo tanto, solo presentaba un resto radicular en posición subgingival. El resto radicular se diagnosticó como no restaurable por lo que se valoraron detenidamente las opciones terapéuticas disponibles con la paciente. Se decidió reemplazar el diente 1.2 con un implante dental y se elaboró el siguiente plan de tratamiento y secuencia clínica; Fase I: extracción del resto radicular 1.2 y reconstrucción del proceso alveolar utilizando un procedimiento de preservación alveolar no invasivo. Restauración provisional inmediata mediante una prótesis parcial de acrílico removible. Fase II: colocación guiada de un implante y aumento de espesor mucoso mediante un injerto de tejido conectivo. Fase III: conformación y modelado del perfil de emergencia mediante una prótesis provisional directa a implante y restauración cerámica sobre implante definitiva.
1.2. Tratamiento
-Fase I: se realizó la extracción atraumática del resto radicular 1.2 y se efectuó un legrado del tejido de granulación. A continuación, se realizó el relleno del alveolo mediante un injerto óseo bovino inorgánico (0,25-1mm) combinado con fibrina autóloga rica en plaquetas y leucocitos. Finalmente, se suturó aproximando los bordes mediante 4 puntos simples desde el margen mucoso vestibular al palatino. Después, la paciente siguió usando su prótesis parcial removible como restauración provisional (Figura 1).
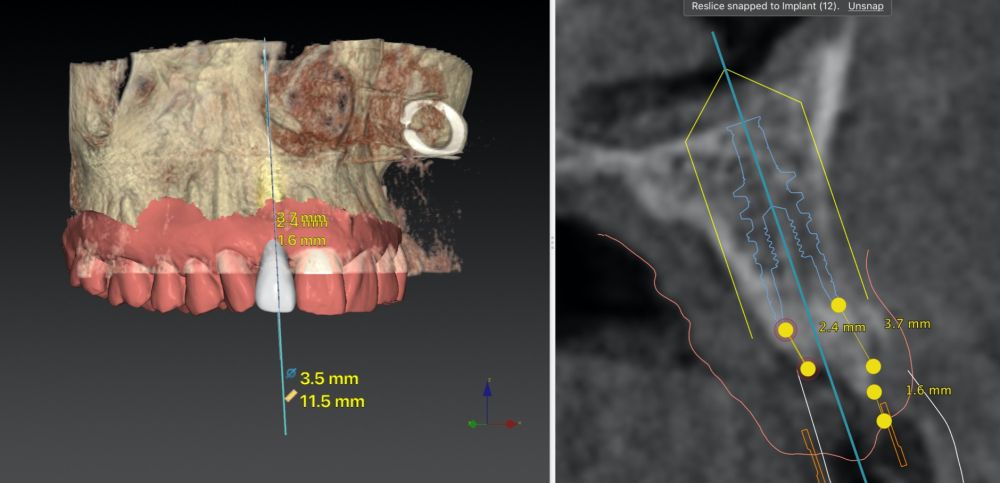
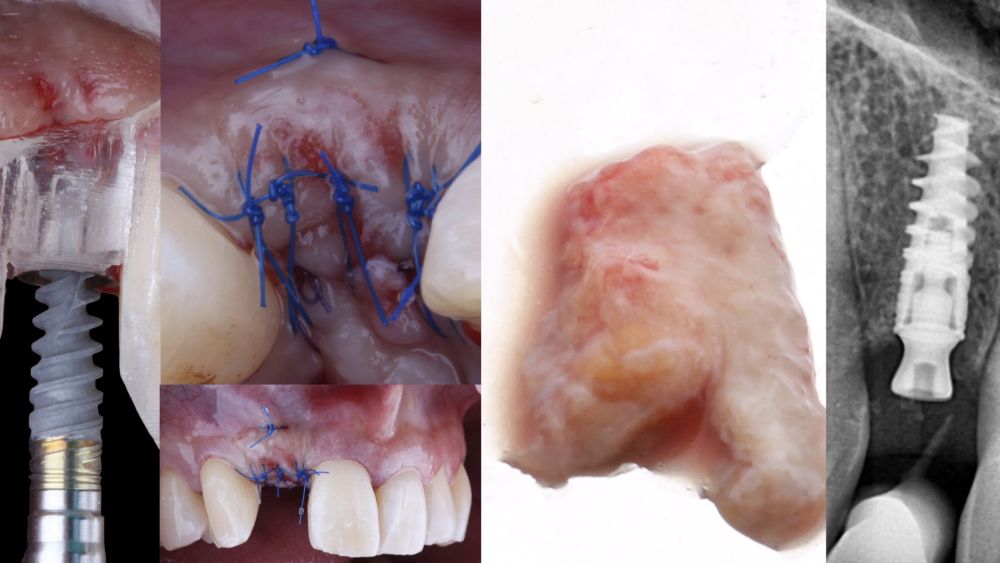
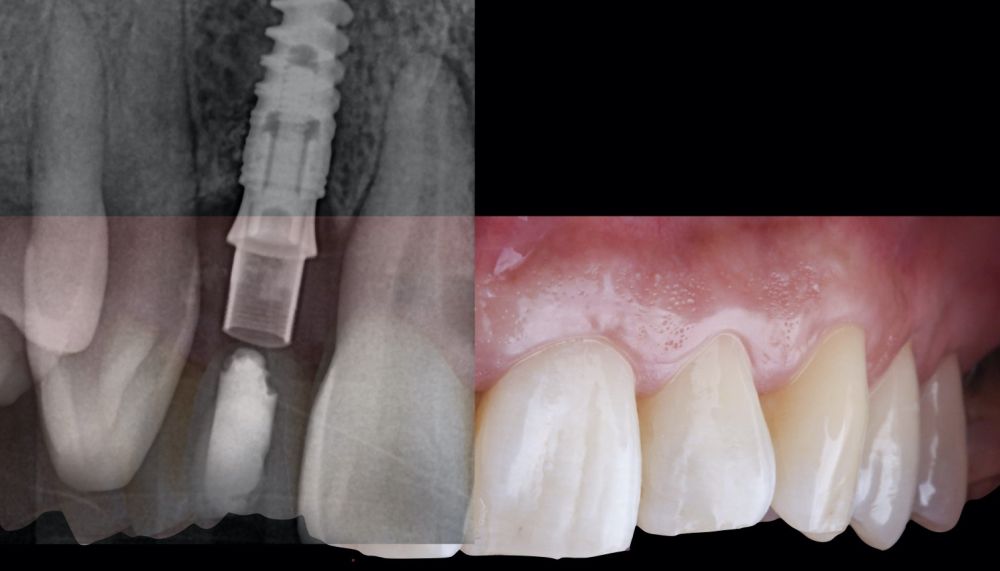
-Fase II: la cicatrización transcurrió sin complicaciones. Tras 5 meses de la cirugía de preservación alveolar, se planificó la cirugía implantológica guiada en posición 1.2 (Figura 2). Para ello, se utilizaron un archivo DICOM procedente de la tomografía computarizada de haz cónico (CBCT) y el archivo STL procedente del escaneado mediante un escáner óptico intraoral. Con esta información se construyó una férula quirúrgica de soporte dental (Figura 3). La férula quirúrgica se ancló sobre los dientes y guió la realización del lecho implantario y la colocación del implante. La técnica quirúrgica de cirugía guiada consistió en una cirugía con colgajo, preparando e insertando el implante (3,5 x 11,5 mm) según el protocolo estandarizado de cirugía guiada Nobel Active® (Nobel Biocare AB, Gothenburg, Sweden). Una vez colocado el implante 1.2, se obtuvo un injerto gingival compuesto de epitelio y tejido conectivo de la mucosa masticatoria palatina. A continuación, se realizó la desepitelización de la capa superficial de dicho injerto fuera de boca mediante una hoja de bisturí 15C con la finalidad de obtener un injerto de tejido conectivo de la capa subyacente18.
El injerto desepitelizado se insertó y posicionó por vestibular y oclusal mediante un punto colchonero horizontales utilizando sutura 5-0 no reabsorbible (Figura 4)19.
La medicación posquirúrgica incluyó un antibiótico (1gr de Amoxicilina 2 veces al día durante 7 días) y un antiinflamatorio (25 mg de Dexketoprofeno 3 veces al día durante 5 días). Las suturas se retiraron a los 10 días después de la intervención.
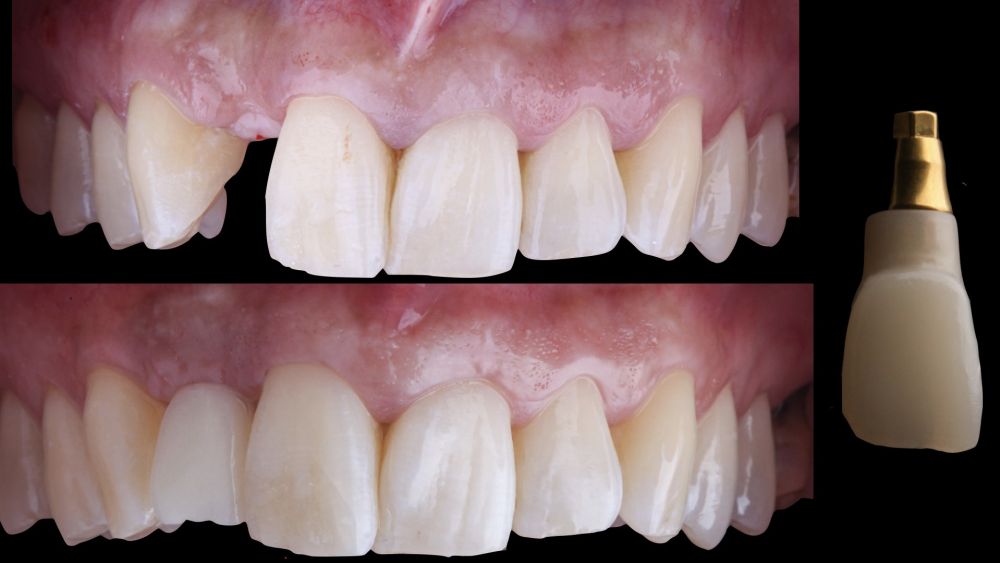
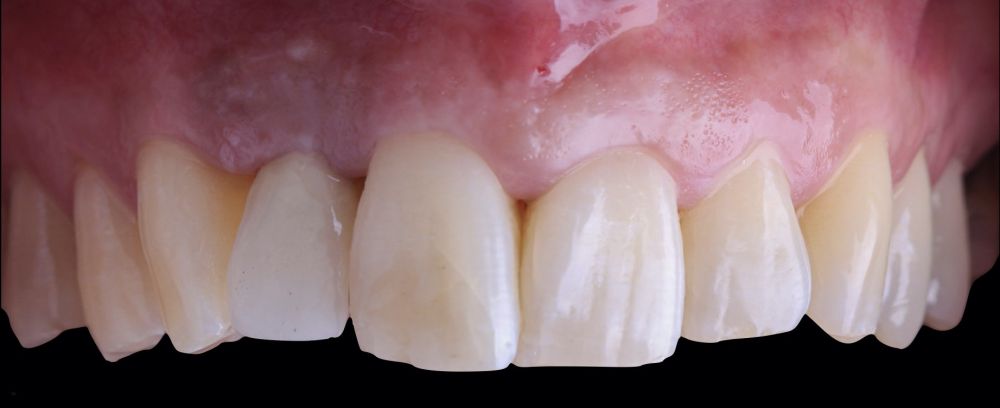
-Fase III: tres meses tras la colocación del implante, la situación del tejido blando era favorable (Figuras 5 y 6). Se tomó una impresión digital mediante escáner intraoral para la realización de un provisional atornillado de polimetilmetacrilato (PMMA). Respecto a la corona implantaria definitiva se realizó una restauración cemento-atornillada con una interfase de titanio nitrurado adaptando el diseño al perfil de emergencia ya consolidado con la prótesis provisional. La corona se realizó por CAD-CAM en zirconio con reducción completa y estratificación de cerámica feldespática de recubrimiento para zirconio (Figura 7).
1.3 Mediciones digitales del tejido blando vestibular aumentado
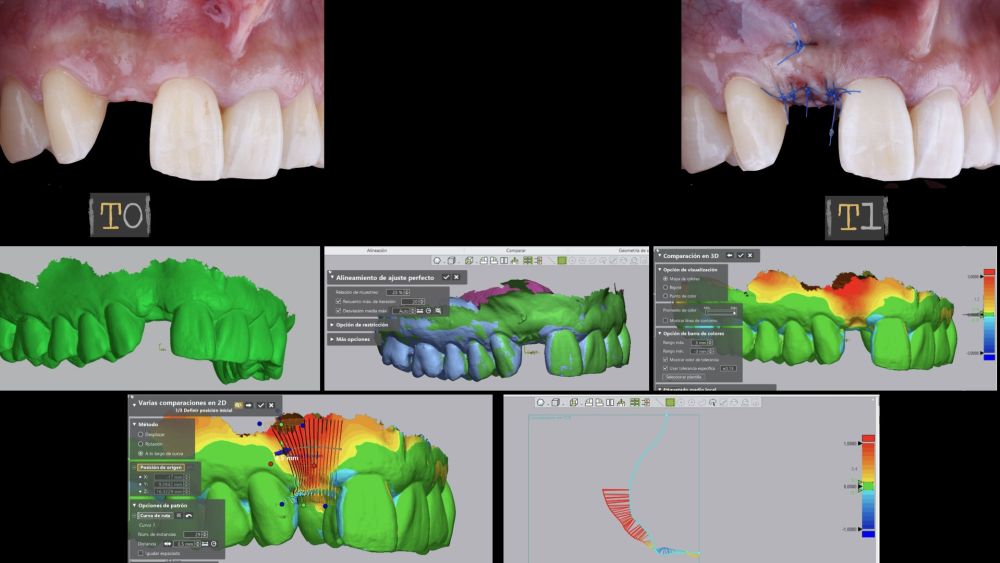
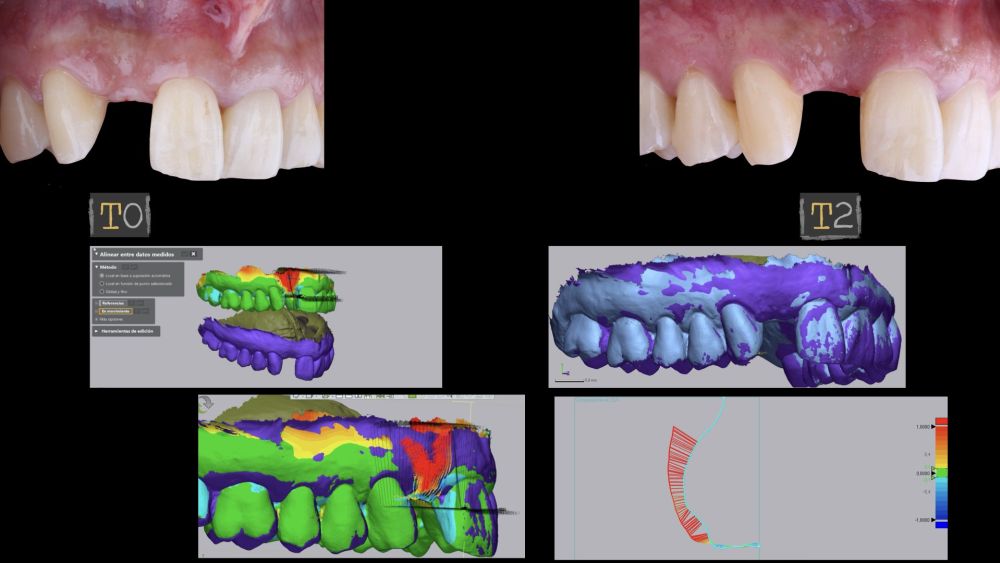
El sitio donde se realizó la cirugía (implante 1.2), junto a su arco completo, se escanearon utilizando un escáner óptico intraoral en diferentes periodos de tiempo; tres semanas antes de la cirugía (T0), inmediatamente después de la cirugía (T1) y al mes y medio tras la cirugía (T2). Los modelos digitales generados se exportaron y guardaron como archivos STL para posteriormente importarlos al software de análisis de imágenes (Geomagic® Control X™; 3D Systems, Rockhill, SC). Se realizó el análisis de los cambios de espesor preoperatorios (T0) frente a los postoperatorios (T1 y T2). Estos cambios de espesor longitudinales se analizaron en la cara vestibular de la corona implantosoportada con la función “3D Compare”, lo que permitió crear un mapa de colores tras la superposición de los modelos, para analizar cuantitativamente las variaciones ocurridas en las áreas de intervención. El mapa de colores oscila entre +3 mm hasta -3 mm, con una tolerancia de ± 0,15 mm y se interpreta de la siguiente manera: áreas verdes corresponden a un alineamiento perfecto de los modelos; los colores rojos, naranjas y amarillos se interpretan como una ganancia de volumen y los colores azul oscuro y claro representan respectivamente una pérdida volumétrica (Figuras 8 y 9). Posteriormente, se diseñó una región de interés rectangular para el estudio del área de intervención donde se evaluaron los cambios lineales de la mucosa periimplantaria (Figuras 8 y 9). La extensión horizontal de la región de interés abarcó ambas papilas (mesial y distal) cubriendo el contorno marginal de la corona implantaría hasta la superficie marginal de los dientes adyacentes. Para informar los resultados de interés, se identificaron puntos en el plano horizontal previamente diseñado en la cara vestibular del implante, comenzando desde mesial y extendiéndose 0,5 mm de distancia en dirección distal. Los valores positivos indicaron que los tejidos periimplantarios estaban ubicados más bucalmente (> grosor) mientras que los negativos denotaron que los tejidos periimplantarios estaban ubicados más a palatino (< grosor).
El resultado clínico final fue satisfactorio cumpliendo las demandas estéticas del paciente. Los tejidos blandos estaban morfológicamente y dimensionalmente estables sin ningún signo de inflamación. Sin embargo, los cambios del tejido blando periimplantario (espesor volumétrico vestibular) fueron demostrados de manera cualitativa y cuantitativa (Figuras 8 y 9). En el postoperatorio inmediato (T1), la ganancia media obtenida al comparar T0 frente a T1 fue de 0,88 ± 0,15 mm con un incremento máximo de 1,1 mm. Al comparar T0–T2, se observó una ganancia media de 0,73 ± 0,23 mm. Es decir, se ha producido una contracción de volumen de 0,16 mm desde la colocación del injerto (T1) hasta pasado un mes y medio (T2).
La pérdida de un diente en el sector estético representa un reto para el odontólogo ya que precisa de un abordaje multidisciplinar y un abordaje integral para recuperar función y estética. Con el fin de optimizar los resultados estéticos y reducir el cambio óseo dimensional que se produce tras una extracción dental, el uso de sustitutos óseos ha demostrado ventajas frente a la cicatrización del alveolo sin injertos óseos20,21. Respecto al uso de fibrina autóloga rica en plaquetas y leucocitos, Pichotano y cols. demostraron que su aplicación junto con un xenoinjerto en regeneración ósea, acelera el proceso de cicatrización ósea que resulta en un incremento en la formación de nuevo hueso22.
Por otra parte, el uso de injerto de tejido conectivo es considerado la técnica de elección que, ayuda a compensar la contracción de los tejidos blandos periimplantarios, por lo tanto, favorece la estética rosa. Sharma y cols. en su estudio clínico realizaron mediciones gingivales alrededor del área de los incisivos laterales maxilares y mandibulares23. Estos autores encontraron que el espesor gingival medio oscilaba entre 0,56 y 1,02 mm. Estos valores medios indican o aconsejan aumentar el espesor de mucosa sobre los implantes, ya que los tejidos del propio paciente no son lo suficientemente gruesos (<2mm de espesor mucoso)8.
En el presente caso clínico, se colocó un injerto de tejido conectivo desepitelizado por vestibular y oclusal obteniendo mayor espesor mucoso y mayor altura del tejido supracrestal. La literatura describe las ventajas de realizar aumentos de tejidos blandos periimplantarios siendo beneficiosos no solo para minimizar la recesión de la mucosa vestibular sino que también, ayudan a la estabilidad ósea periimplantaria 9,23–25. El estudio de Thoma y cols. con un periodo de seguimiento de hasta 3 años, observaron cambios mínimos en el grosor del tejido blando periimplantario en los sitios de implantes previamente injertados con una membrana xenogénica (-0,2 mm) frente a un injerto de tejido conectivo subepitelial (-0,1 mm)26. Además, encontraron mayores aumentos de espesor mucoso con el uso de injerto de conectivo autólogo frente al uso del sustituto xenogénico (0,3 mm en promedio más alto para el uso injerto conectivo autólogo). Sin embargo, los datos obtenidos en nuestro trabajo para el espesor mucoso no se pueden comparar con los datos de Thoma y cols, ya que nuestro trabajo tiene un periodo de seguimiento corto (un mes y medio aproximadamente) y solo analiza el cambio producido entre T0–T1 y T0–T2, no analizando el espesor inicial de tejido mucoso periimplantario26. Si Podemos observar en nuestro estudio que entre T1 y T2 el injerto de conectivo sufre contracciones durante su cicatrización (en promedio 0,16 mm).
Por otro lado, la cirugía de implantes guiada fue descrita en la literatura como una técnica prometedora que mejora la precisión tanto en la planificación prequirúrgica como en la colocación de implantes3. Además, las guías quirúrgicas dentosoportadas tienen mejor precisión en comparación con las guías de soporte óseo27. Asimismo, el uso de una guía dentosoportada sin la realización de grandes colgajos podría ser la mejor opción tanto para el profesional como para el paciente28. De igual modo, la planificación virtual permite optimizar la colocación de los implantes en zonas con una anatomía compleja y situaciones de atrofia ósea gracias a la visualización directa del volumen óseo presente29. Por otro lado, ofrece la posibilidad de realizar procedimientos de carga inmediata de forma segura y predecible28.
Entre las limitaciones asociadas a esta técnica, se destacan su coste elevado en comparación con la técnica convencional, las posibles fracturas de la férula quirúrgica durante la intervención y la necesidad de llevarse a cabo en condiciones anatómicas favorables, ya que requiere el uso de instrumental específico que puede estar restringido a situaciones donde no exista una apertura bucal limitada. Además, la realización de una restauración temporal inmediata puede verse afectada por pequeñas variaciones entre la posición real y planificada del implante, lo que puede ocasionar la aparición de pequeños desajustes3,29–32. Otra desventaja respecto a las distintas fases del protocolo quirúrgico presentado, es el mayor número de intervenciones quirúrgicas realizadas.
El caso presentado representa un enfoque multidisciplinar ante la pérdida de un diente en el sector estético. Conviene destacar que el tratamiento minucioso de los tejidos duros y blandos, así como la planificación mediante cirugía guiada aumenta la precisión en relación con la posición ideal desde el punto de vista prostodóncico, lo que repercutirá en la estabilidad a largo plazo de tejidos duros y blandos. El presente análisis volumétrico sugiere que tras la realización de un injerto de tejido conectivo se produce una ganancia que tras un mes y medio disminuye.
Vercruyssen M, Laleman I, Jacobs R, et al. Computer-supported implant planning and guided surgery: a narrative review. Clin Oral Implants Res. 2015;26(S11):69-76.
Tatakis DN, Chien HH, Parashis AO. Guided implant surgery risks and their prevention. Periodontol 2000. 2019;81(1):194-208.
Pimkhaokham A, Jiaranuchart S, Kaboosaya B, et al. Can computer-assisted implant surgery improve clinical outcomes and reduce the frequency and intensity of complications in implant dentistry? A critical review. Periodontol 2000. 2022;90(1):197-223.
Apostolakis D, Brown JE. The anterior loop of the inferior alveolar nerve: prevalence, measurement of its length and a recommendation for interforaminal implant installation based on cone beam CT imaging. Clin Oral Implants Res. 2012;23(9):1022-1030.
Romandini M, Ruales-Carrera E, Sadilina S, et al. Minimal invasiveness at dental implant placement: A systematic review with meta-analyses on flapless fully guided surgery. Periodontol 2000. 2023;91(1):89-112.
Chackartchi T, Romanos GE, Parkanyi L, et al. Reducing errors in guided implant surgery to optimize treatment outcomes. Periodontol 2000. 2022;88(1):64-72.
Ávila G, González O, Couso E, et al. The peri-implant phenotype. J Periodontol. 2020;91(3):283-288.
Monje A, González O, Ávila G. Impact of peri-implant soft tissue characteristics on health and esthetics. J Esthet Restor Dent. 2023;35(1):183-196.
Thoma DS, Gasser TJW, Hämmerle CHF, et al. Soft tissue augmentation with a volume-stable collagen matrix or an autogenous connective tissue graft at implant sites: Five-year results of a randomized controlled trial post implant loading. J Periodontol. 2023;94(2):230-243.
Thoma DS, Strauss FJ, Mancini L, et al. Minimal invasiveness in soft tissue augmentation at dental implants: A systematic review and meta-analysis of patient-reported outcome measures. Periodontol 2000. 2023;91(1):182-198.
Tavelli L, Barootchi S, Ávila G, et al. Peri-implant soft tissue phenotype modification and its impact on peri-implant health: A systematic review and network meta-analysis. J Periodontol. 2021;92(1):21-44.
Ávila G, Couso E, Pirc M, et al. Outcome measures and methods of assessment of soft tissue augmentation interventions in the context of dental implant therapy: A systematic review of clinical studies published in the last 10 years. J Clin Periodontol. 2023;50(S25):83-95.
Wismeijer D, Joda T, Flügge T, et al. Group 5 ITI Consensus Report: Digital technologies. Clin Oral Implants Res. 2018;29(S16):436-442.
Fan S, Sáenz-Ravello G, Al-Nawas B, et al. The feasibility of ultrasonography for the measurement of periodontal and peri-implant phenotype: A systematic review and meta-analysis. Clin Implant Dent Relat Res. 2023;25(5):892-909.
Pirc M, Harbeck O, Sapata VM, et al. Contour changes of peri-implant tissues are minimal and similar for a one- and a two-piece implant system over 12 years. Clin Oral Investig. 2021;25(2):719-727.
Strauss FJ, Gil A, Smirani R, et al. The use of digital technologies in peri-implant soft tissue augmentation – A narrative review on planning, measurements, monitoring and aesthetics. Clin Oral Implants Res. 2024 (2). doi: 10.1111/clr.14238.
Fernandes D, Marques T, Borges T, et al. Volumetric analysis on the use of customized healing abutments with or without connective tissue graft at flapless maxillary immediate implant placement: A randomized clinical trial. Clin Oral Implants Res. 2023;34(9):934-946.
Zucchelli G, Mele M, Stefanini M, et al. Patient morbidity and root coverage outcome after subepithelial connective tissue and de-epithelialized grafts: a comparative randomized-controlled clinical trial. J Clin Periodontol. 2010;37(8):728-738.
González D, Cabello G, Olmos G, et al. The saddle connective tissue graft: a periodontal plastic surgery technique to obtain soft tissue coronal gain on immediate implants. A case report. Int J Esthet Dent. 2015;10(3):444-455.
Araújo MG, da Silva JCC, de Mendonça AF, et al. Ridge alterations following grafting of fresh extraction sockets in man. A randomized clinical trial. Clin Oral Implants Res. 2015;26(4):407-412.
Sanz M, Lindhe J, Alcaraz J, Sanz-Sanchez I, et al. The effect of placing a bone replacement graft in the gap at immediately placed implants: a randomized clinical trial. Clin Oral Implants Res. 2017;28(8):902-910.
Pichotano EC, de Molon RS, Freitas de Paula LG, et al. Early Placement of Dental Implants in Maxillary Sinus Grafted With Leukocyte and Platelet-Rich Fibrin and Deproteinized Bovine Bone Mineral. J Oral Implantol. 2018;44(3):199-206.
Sharma S, Thakur SL, Joshi SK, et al. Measurement of gingival thickness using digital vernier caliper and ultrasonographic method: a comparative study. J Investig Clin Dent. 2014;5(2):138-143.
Lee CT, Tao CY, Stoupel J. The Effect of Subepithelial Connective Tissue Graft Placement on Esthetic Outcomes After Immediate Implant Placement: Systematic Review. J Periodontol. 2016;87(2):156-167.
Frizzera F, de Freitas RM, Muñoz-Chávez OF, et al. Impact of Soft Tissue Grafts to Reduce Peri-implant Alterations After Immediate Implant Placement and Provisionalization in Compromised Sockets. Int J Periodontics Restorative Dent. 2019;39(3):381-389.
Atieh MA, Alsabeeha NHM. Soft tissue changes after connective tissue grafts around immediately placed and restored dental implants in the esthetic zone: A systematic review and meta-analysis. J Esthet Restor Dent Off Publ Am Acad Esthet Dent Al. 2020;32(3):280-290.
Thoma DS, Gasser TJW, Jung RE, et al. Randomized controlled clinical trial comparing implant sites augmented with a volume-stable collagen matrix or an autogenous connective tissue graft: 3-year data after insertion of reconstructions. J Clin Periodontol. 2020;47(5):630-639.
Raico Gallardo YN, da Silva-Olivio IRT, Mukai E, et al. Accuracy comparison of guided surgery for dental implants according to the tissue of support: a systematic review and meta-analysis. Clin Oral Implants Res. 2017;28(5):602-612.
Gargallo J, Barootchi S, Salomó O, et al. Advantages and disadvantages of implant navigation surgery. A systematic review. Ann Anat – Anat Anz. 2019;225:1-10.
D’haese J, Ackhurst J, Wismeijer D, et al. Current state of the art of computer-guided implant surgery. Periodontol 2000. 2017;73(1):121-133.
Smitkarn P, Subbalekha K, Mattheos N, et al. The accuracy of single-tooth implants placed using fully digital-guided surgery and freehand implant surgery. J Clin Periodontol. 2019;46(9):949-957.
Tattan M, Chambrone L, González-Martín O, et al. Static computer-aided, partially guided, and free-handed implant placement: A systematic review and meta-analysis of randomized controlled trials. Clin Oral Implants Res. 2020;31(10):889-916.
Quispe N, Flores J, Pardal B, et al. Factors Influencing the Accuracy of Guided Surgery: An In Vitro Trial. Int J Oral Maxillofac Implants. 2023;38(1):120-129.

Quispe López, Norberto
Profesor asociado al departamento de cirugía área estomatología Universidad de Salamanca (USAL).
Dahdouh, Manar
Alumna 5º grado de Odontología, Universidad de Salamanca (USAL).
Ledesma Sánchez, Lucía
Alumna 5º grado de Odontología, Universidad de Salamanca (USAL).
Rodríguez Muñoz, Pablo
Alumno 4º grado de Odontología, Universidad de Salamanca (USAL).