Revisión bibliográfica
Ouazzani Touhami M, Ruiz Rincón M, Benito López P, Bazal Bonelli S, Sánchez-Labrador L, López-Quiles Martínez J. Osteonecrosis en mandíbula y/o maxilar en pacientes tratados con anticuerpos monoclonales: revisión de la literatura. Cient. Dent. 2024; 21; 2; 83-89.
Osteonecrosis en mandíbula y/o maxilar en pacientes tratados con anticuerpos monoclonales: revisión de la literatura
Introducción: En la última década, los anticuerpos monoclonales han revolucionado el campo de la medicina moderna. Se tratan de proteínas diseñadas para unirse específicamente a determinadas moléculas para el tratamiento de ciertos tipos de cáncer y enfermedades autoinmunes. El objetivo de este estudio fue analizar la relación entre el tratamiento con anticuerpos monoclonales y la osteonecrosis en mandíbula y/o maxilar analizando la incidencia y los factores de riesgo asociados.
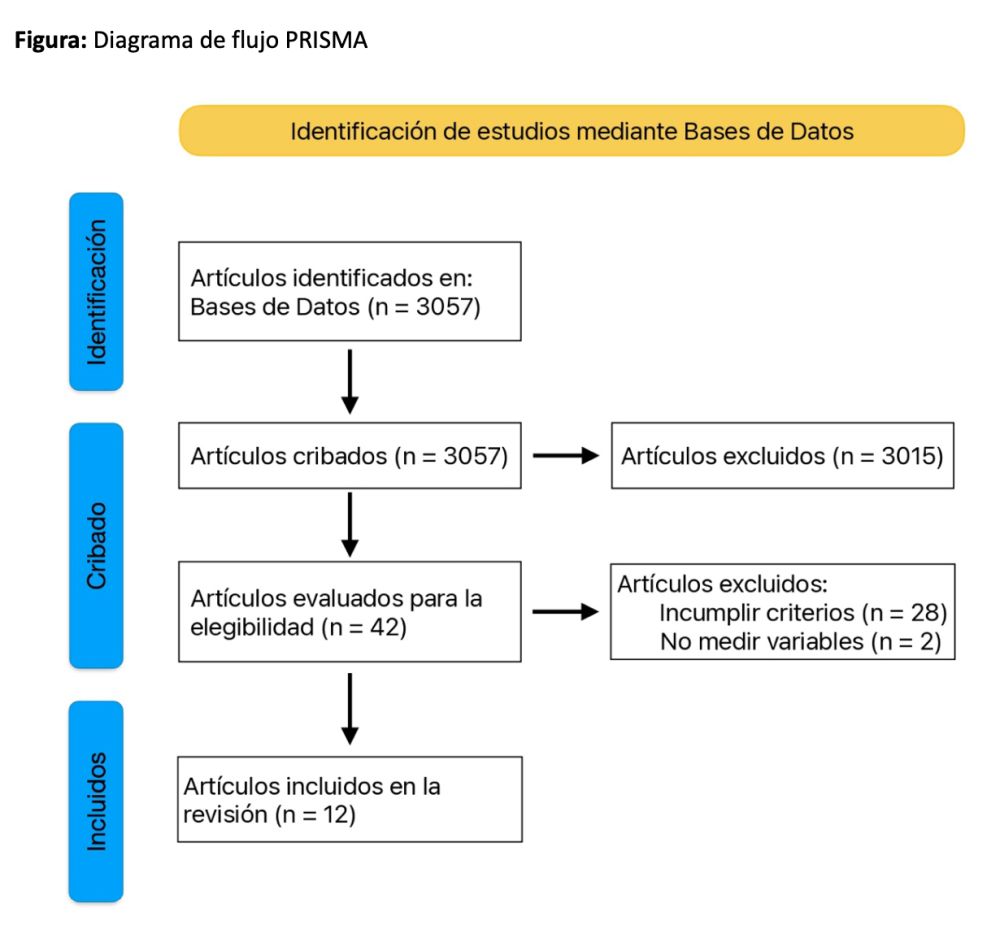
Métodos: Se obtuvieron inicialmente un total de 3057 resultados. Tras realizar un primer cribado de los artículos que no cumplieron los criterios de inclusión, se seleccionaron 42 artículos para leer a texto completo. Finalmente, se incluyeron 13 ensayos clínicos aleatorizados.
Resultados: El número total de pacientes incluidos fue de 16259. La incidencia media de los casos de osteonecrosis fue de 3,87%. Se registraron 51 casos leves de osteonecrosis (estadio 1-2) y 16 severos (estadio 3). Los factores de riesgo analizados fueron el uso de prótesis desajustadas, procedimientos dentales invasivos, enfermedad periodontal y el uso de corticoides.
Conclusiones: La incidencia media de osteonecrosis inducida por anticuerpos monoclonales fue del 3,87%. El uso de prótesis desajustadas, exodoncias, enfermedad periodontal y uso de corticoides pueden favorecer el desarrollo de osteonecrosis inducida por anticuerpos monoclonales. Son necesarios estudios de mayor calidad y con mayor tiempo de seguimiento para llegar a afirmaciones más contundentes.
Osteonecrosis of the jaws in patients treated with monoclonal antibodies: A review of the literature
Introduction:
In the last decade, monoclonal antibodies have revolutionized the field of modern medicine. These are proteins designed to bind specifically to certain molecules for the treatment of certain types of cancer and autoimmune diseases.
The aim of this study was to analyze the relationship between treatment with monoclonal antibodies and osteonecrosis of the jaws by analyzing the incidence and associated risk factors.
Methods: A total of 3057 results were initially obtained. After an initial screening of articles that did not meet the inclusion criteria, 42 articles were selected for full-text reading. Finally, 13 randomized clinical trials were included.
Results: The total number of patients included was 16259. The mean incidence of osteonecrosis cases was 3.87%. There were 51 mild cases of osteonecrosis (stage 1-2) and 16 severe cases (stage 3). The risk factors analyzed were the use of mismatched prostheses, invasive dental procedures, periodontal disease and the use of corticosteroids.
Conclusions: The mean incidence of monoclonal antibody-induced osteonecrosis was 3.87%. The use of misaligned prostheses, tooth extraction, periodontal disease and the use of corticosteroids may favor the development of monoclonal antibody-induced osteonecrosis. Studies of higher quality and with longer follow-up time are necessary to reach more conclusive statements.
Keywords: Monoclonal antibodies; Antiresorptive drugs; Osteonecrosis of the jaws.
Los anticuerpos monoclonales (AM) son moléculas que actúan como sustitutos a los anticuerpos endógenos para restablecer, mejorar o imitar la actividad del sistema inmune1. Los AM revolucionaron el tratamiento de las enfermedades autoinmunes, alérgicas e infecciosas, siendo útiles en casos de esclerosis múltiple, metástasis óseas y osteoporosis2-4.
Se distinguen cuatro tipos de anticuerpos monoclonales según su origen: murinos, quiméricos, humanizados y humanos. Los más utilizados y prescritos actualmente son los humanizados, que se identifican con el sufijo -zumab (romosozumab) y los humanos, que se identifican con el sufijo -umab (denosumab), aunque estos últimos son menos antigénicos, mejor tolerados y tienen una vida media más larga. Ambos actúan inhibiendo la actividad de los osteoclastos, reduciendo la resorción ósea y aumentando la densidad ósea3, con un mecanismo de acción altamente específico mediante la inhibición del receptor activador del ligando nuclear factor-kappa B (RANKL)5.
El RANKL es un factor crítico en la reabsorción ósea, ya que desempeña un papel básico en la formación, función y supervivencia de los osteoclastos. El inhibidor del RANKL es la osteoprotegerina, que al igual que los AM, compite con el RANKL para unirse al RANK, neutralizando así sus efectos. De este modo, la inhibición del RANKL permite aumentar la densidad ósea6,7.
Debido a su mecanismo de acción, estos medicamentos pueden tener varios efectos secundarios, como son el aumento de infecciones, el daño hepático y la osteonecrosis de los maxilares (ONM), que es una afección poco frecuente, pero grave, que se manifiesta como una o más lesiones óseas necróticas que están expuestas o pueden palparse a través de una fístula intraoral o extraoral en la región maxilofacial, y persisten durante al menos 8 semanas sin respuesta a un tratamiento adecuado8,9.
La Asociación Americana de Cirujanos Orales y Maxilofaciales (AAOMS) introdujo el sistema de estadios para clasificar la sintomatología de la ONM y facilitar la toma de decisiones para su tratamiento8. (Tabla 1)
| Estadio 0 | Sintomatología y clínica no específica sin evidencia de hueso necrótico |
| Estadio 1 | Hueso expuesto y necrótico o fístula que llega al hueso en pacientes que no presentan síntomas ni evidencia de infección o inflamación. |
| Estadio 2 | Hueso expuesto y necrótico o fístula que llega al hueso en pacientes sintomáticos |
| Estadio 3 | Estadio 2 + uno o más:
· Hueso necrótico expuesto que se extiende más allá de la región alveolar · Fractura patológica · Fistula extraoral · Comunicación orosinusal u oronasal · Osteólisis que se extiende más allá del borde inferior de la mandíbula o del suelo del seno |
En la última década se ha aumentado el uso de los AM y, por tanto, el objetivo de esta revisión de la literatura fue analizar la relación entre el tratamiento con AM y la incidencia de la ONM y los factores de riesgo en pacientes con ONM tratados con AM.
Fuentes y estrategia de búsqueda: Se realizó una búsqueda bibliográfica, a través de la base de datos Pub-Med/Medline, usando como palabras clave: [(monoclonal antibodies) OR (antiresorptive drugs)] AND [(osteonecrosis of the jaw) OR (ONJ)].
Criterios de inclusión: Se incluyeron ensayos clínicos aleatorizados (ECAs) de los últimos 10 años en los que se describiera la incidencia de ONM en pacientes tratados con AM.
Criterios de exclusión: Se excluyeron estudios in vitro, estudios en animales y estudios observacionales. También se excluyeron ECAs que informaran sobre ONM causada por otro tipo de fármacos que no fueran AM.
Artículos seleccionados: Tras la búsqueda inicial, se obtuvieron un total 3057 resultados. Se realizó un primer cribado descartando aquellos artículos que no cumplieron con los criterios de inclusión por el título y el resumen. A continuación, se leyeron a texto completo 42 artículos, para finalmente incluir en la revisión 12 artículos (Figura).
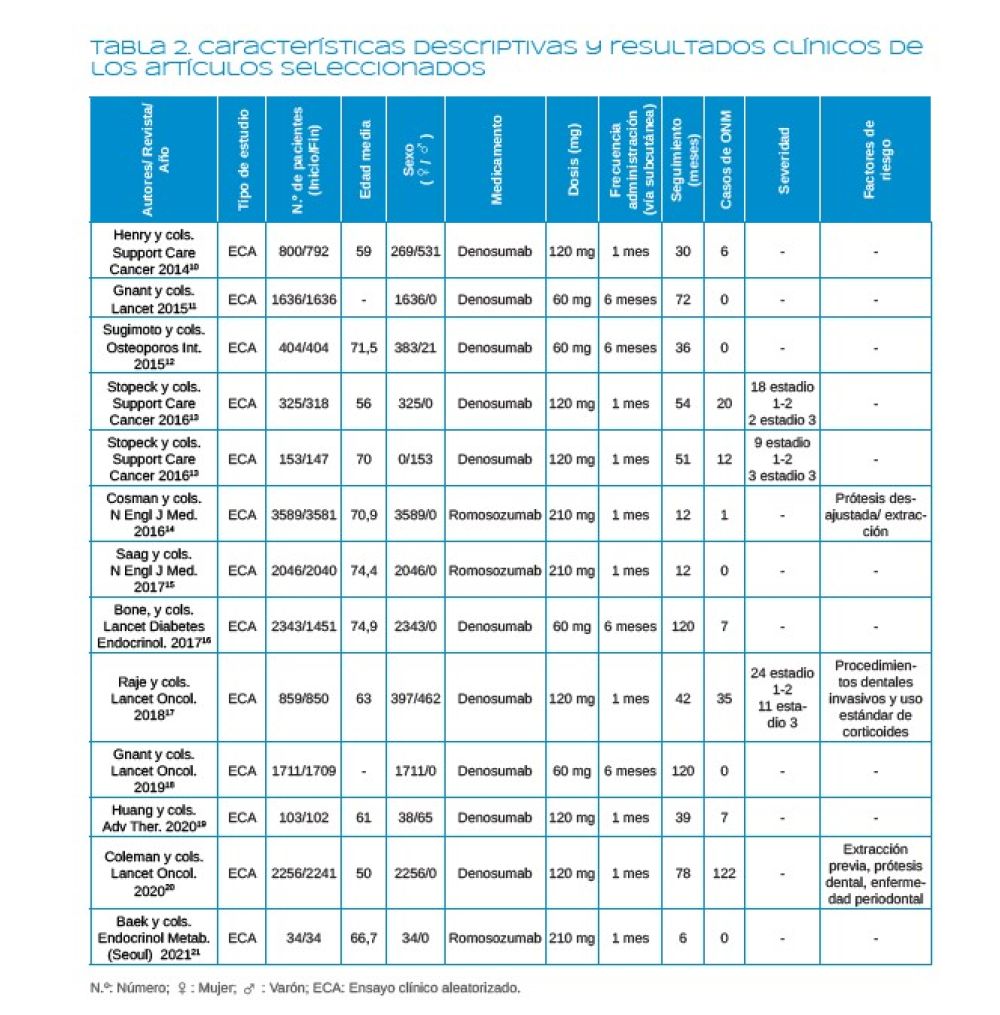
Información registrada de los artículos: Se registraron los nombres de los autores, el año de publicación, el número, sexo y edad de los pacientes, el tiempo de seguimiento, el tipo, dosis y frecuencia de administración del AM utilizado, el número de casos notificados, la gravedad y los factores de riesgo.
En total, se analizaron 13 ECAs, ya que el artículo de Stopeck y cols.13 presentaba dos estudios. El número total de pacientes fue de 16259, 15027 mujeres y 1232 hombres, con una edad media de 65,22 años.
El AM más utilizado fue el denosumab que se analizó en 10 estudios empleándose en una dosis de entre 60mg cada 6 meses y 120mg cada mes. El otro AM analizado en tres estudios fue el romosozumab utilizándose en una dosis de 210mg cada mes. El seguimiento de los pacientes fue de 6-120 meses.
En 5 estudios11,12,15,18,21 no se notificaron casos de ONM, mientras que en los 7 estudios restantes10,13,14,16,17,19,20 se observó una incidencia de entre 0,028-8% (media de 3,87%). La gravedad de los casos de ONM se analizó, únicamente, en 3 estudios13,17, notificándose 51 casos leves (estadio 1-2) y 16 severos (estadio 3). Por último, los factores asociados a la aparición de ONM se analizaron en 3 estudios14,17,20 en los que se describió el uso de prótesis desajustadas, exodoncias, procedimientos dentales invasivos, enfermedad periodontal y el uso de corticoides (Tabla 2).
La ONM es una patología poco frecuente que empeora considerablemente la calidad de vida de los pacientes. En esta revisión bibliográfica, se incluyeron 12 estudios en los que se documentaron casos de pacientes que tomaron AM, siendo el más utilizado el denosumab (60mg/cada 6 meses)11,12,16,18.
La mayoría de los casos estudiados fueron mujeres (92,4%), esto puede explicarse debido a la alta prevalencia de osteoporosis tras la menopausia. Los tratamientos más utilizados para tratar la osteoporosis son el ácido zoledrónico, el denosumab y la teriparatida, ya que presentan una alta eficacia para reducir el riesgo de fracturas óseas22.
La ONM se localiza con mayor frecuencia en la mandíbula22,23, pero puede detectarse también en el maxilar24. Además, puede ir acompañada de dolor, inflamación, eritema, supuración y pérdida de dientes. Aunque la ONM puede aparecer de forma espontánea, en la mayoría de los casos es el resultado de un procedimiento quirúrgico en la cavidad bucal25.
Con respecto a la incidencia de ONM, se observó una variación de entre el 0% y el 8%, pudiendo ser debido a las diferencias de tamaños muestrales entre los estudios y al tiempo de seguimiento. Además, si se compara la incidencia media obtenida en esta revisión (3,87%) con otros fármacos que también pueden producir ONM, como los bisfosfonatos por vía intravenosa (1,3-3,2% tras 3 años de seguimiento) y orales (entre 1-2,3% tras 3 años de seguimiento), se observa que la incidencia de ONM tomando AM es más alta26,27. Este aumento en la incidencia ya se describió en el estudio de Loyson y cols.28, donde se constató un mayor riesgo de padecer ONM en pacientes que cambiaron de bisfosfonatos a AM. Aunque, cabe destacar que el efecto de los bisfosfonatos en el hueso puede durar hasta 3 años después de la última administración, a diferencia de los AM, que no tienen efecto acumulativo22.
Se describieron los factores de riesgo de las ONM por AM en 3 estudios14,17,20. Los factores de riesgo de las ONM relacionadas con el uso de AM que se describieron son similares a las ONM causada por bisfosfonatos: uso de prótesis desajustadas, exodoncias, procedimientos dentales invasivos, enfermedad periodontal y uso de corticoides. Además, la ONM causada por bisfosfonatos presenta otros factores de riesgo como la dosis acumulativa de bisfosfonatos en sangre y el hábito tabáquico29.
En este sentido, es importante tener un programa de revisión de los pacientes tratados con AM, ya que la mayoría de los casos diagnosticados de ONM relacionados con AM son leves (estadios 1-2). El 76% de los casos en los que se registra el estadio son leves, por lo que cobra especial importancia poder realizar un diagnóstico temprano de la ONM30.
De cara al tratamiento de la ONM, se describen en la literatura tratamientos coadyuvantes (antibióticos, enjuagues orales) para los casos leves (estadios 1-2). En estadios 3, para aquellos casos que no responden al tratamiento coadyuvante, se deben emplear procedimientos quirúrgicos (desbridamiento, legrado, eliminación de secuestros y resección ósea), asegurando la eliminación completa del hueso necrótico, el alisado de los bordes óseos y un meticuloso cierre de la herida31. Actualmente se están investigando otras alternativas terapéuticas, como el uso de concentrados plaquetarios, teriparatida, terapia por láser, oxígeno hiperbárico y aplicaciones de ozono. Estas terapias pudieran ser efectivas, aunque actualmente presentan un nivel de evidencia bajo y un tamaño muestral limitado32.
Una de las limitaciones de la presente revisión es el corto tiempo de seguimiento (< 5 años) en nueve de los trece estudios incluidos. Además, en ocho de los trece estudios incluidos la muestra está compuesta exclusivamente por mujeres, por lo que sería interesante determinar la incidencia en función del género. Por último, sería beneficioso comparar la incidencia de ONM entre los AM y otros fármacos antirresortivos.
La incidencia de ONM inducida por AM en esta revisión es superior a la de otros fármacos como los bisfosfonatos orales e intravenosos. Además, parece ser que el uso de prótesis desajustadas, exodoncias, enfermedad periodontal y uso de corticoides pueden favorecer el desarrollo de ONM por ingesta de AM. Aunque son necesarios más ensayos clínicos aleatorizados que comparen los AM con otros fármacos antirresortivos para determinar de manera más exacta la incidencia, la gravedad y los factores de riesgo.
Bayer V. An overview of monoclonal antibodies. Semin Oncol Nurs. 2019;35(5):150927.
Grilo AL, Mantalaris A. The increasingly human and profitable monoclonal antibody market. Trends Biotechnol. 2019;37(1):9-16.
Delmas PD. Clinical potential of RANKL inhibition for the management of postmenopausal osteoporosis and other metabolic bone diseases. J Clin Densitom. 2008;11(2):325-338.
Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009;361(8):756-765.
Boquete-Castro A, Gómez-Moreno G, Calvo-Guirado JL, et al. Denosumab and osteonecrosis of the jaw. A systematic analysis of events reported in clinical trials. Clin Oral Implants Res. 2016;27(3):367-375.
Capparelli C, Morony S, Warmington K, et al. Sustained antiresorptive effects after a single treatment with human recombinant osteoprotegerin (OPG): a pharmacodynamic and pharmacokinetic analysis in rats. J Bone Miner Res. 2003;18(5):852-858.
Kostenuik PJ. Revisiting the seed and soil theory of bone metastasis: new tools, same answer. J Musculoskelet Neuronal Interact. 2004;4(4):375-376.
Ruggiero SL, Dodson TB, Aghaloo T, et al. American Association of Oral and Maxillofacial Surgeons’ position paper on medication-related osteonecrosis of the jaws-2022 Update. J Oral Maxillofac Surg. 2022;80(5):920-943.
McGowan K, McGowan T, Ivanovski S. Risk factors for medication-related osteonecrosis of the jaws: A systematic review. Oral Dis. 2018;24(4):527-536.
Henry D, Vadhan-Raj S, Hirsh V, et al. Delaying skeletal-related events in a randomized phase 3 study of denosumab versus zoledronic acid in patients with advanced cancer: an analysis of data from patients with solid tumors. Support Care Cancer. 2014;22(3):679-687.
Gnant M, Pfeiler G, Dubsky PC, et al. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2015;386(9992):433-443.
Sugimoto T, Matsumoto T, Hosoi T, et al. Three-year denosumab treatment in postmenopausal Japanese women and men with osteoporosis: results from a 1-year open-label extension of the Denosumab Fracture Intervention Randomized Placebo Controlled Trial (DIRECT). Osteoporos Int. 2015;26(2):765-774.
Stopeck AT, Fizazi K, Body JJ, et al. Safety of long-term denosumab therapy: results from the open label extension phase of two phase 3 studies in patients with metastatic breast and prostate cancer. Support Care Cancer. 2016;24(1):447-455.
Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med. 2016;375(16):1532-1543.
Saag KG, Petersen J, Brandi ML, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med. 2017;377(15):1417-1427.
Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017;5(7):513-523.
Raje N, Terpos E, Willenbacher W, et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double-blind, double-dummy, randomised, controlled, phase 3 study. Lancet Oncol. 2018;19(3):370-381.
Gnant M, Pfeiler G, Steger GG, et al. Austrian Breast and Colorectal Cancer Study Group. Adjuvant denosumab in postmenopausal patients with hormone receptor-positive breast cancer (ABCSG-18): disease-free survival results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(3):339-351.
Huang SY, Yoon SS, Shimizu K, et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: An international, double-blind, randomized controlled phase 3 study-asian subgroup analysis. Adv Ther. 2020;37(7):3404-3416.
Coleman R, Finkelstein DM, Barrios C, et al. Adjuvant denosumab in early breast cancer (D-CARE): an international, multicentre, randomised, controlled, phase 3 trial. Lancet Oncol. 2020;21(1):60-72.
Baek KH, Chung YS, Koh JM, et al. Romosozumab in postmenopausal korean women with osteoporosis: A randomized, double-blind, placebo-controlled efficacy and safety study. Endocrinol Metab (Seoul). 2021;36(1):60-69.
Nicolatou-Galitis O, Schiødt M, Mendes RA, et al. Medication-related osteonecrosis of the jaw: definition and best practice for prevention, diagnosis, and treatment. Oral Surg Oral Med Oral Pathol Oral Radiol. 2019;127(2):117-135.
Pazianas M, Miller P, Blumentals WA, et al. A review of the literature on osteonecrosis of the jaw in patients with osteoporosis treated with oral bisphosphonates: prevalence, risk factors, and clinical characteristics. Clin Ther. 2007;29(8):1548-1558.
Filleul O, Crompot E, Saussez S. Bisphosphonate-induced osteonecrosis of the jaw: a review of 2,400 patient cases. J Cancer Res Clin Oncol. 2010;136(8):1117-1124.
Eguia A, Bagán-Debón L, Cardona F. Review and update on drugs related to the development of osteonecrosis of the jaw. Med Oral Patol Oral Cir Bucal. 2020;25(1):e71-e83.
Limones A, Sáez-Alcaide LM, Díaz-Parreño SA, et al. Medication-related osteonecrosis of the jaws (MRONJ) in cancer patients treated with denosumab VS. zoledronic acid: A systematic review and meta-analysis. Med Oral Patol Oral Cir Bucal. 2020;25(3):e326-e336.
Kawahara M, Kuroshima S, Sawase T. Clinical considerations for medication-related osteonecrosis of the jaw: a comprehensive literature review. Int J Implant Dent. 2021;7(1):47.
Loyson T, Van Cann T, Schöffski P, et al. Incidence of osteonecrosis of the jaw in patients with bone metastases treated sequentially with bisphosphonates and denosumab. Acta Clin Belg. 2018;73(2):100-109.
Nisi M, La Ferla F, Karapetsa D, et al. Risk factors influencing BRONJ staging in patients receiving intravenous bisphosphonates: a multivariate analysis. Int J Oral Maxillofac Surg. 2015;44(5):586-591.
Al Abdullateef A, Alhareky MS. Awareness among patient at risk of developing Medication Related Osteonecrosis of the Jaw (MRONJ) – A primary prevention strategy. Saudi Pharm J. 2020;28(6):771-778.
Kün-Darbois JD, Fauvel F. Medication-related osteonecrosis and osteoradionecrosis of the jaws: Update and current management. Morphologie. 2021;105(349):170-187.
Goker F, Grecchi E, Grecchi F, et al. Treatment of medication-related osteonecrosis of the jaw (MRONJ). A systematic review. Eur Rev Med Pharmacol Sci. 2021;25(6):2662-2673.

Ouazzani Touhami, Mohamed
Alumno de Grado por la Universidad Complutense de Madrid (UCM).
Ruiz Rincón, Miguel
Alumno de Grado por la Universidad Complutense de Madrid (UCM).
Benito López, Paula
Alumna de Grado por la Universidad Complutense de Madrid (UCM).
Bazal Bonelli, Santiago
Profesor colaborador del Posgrado de Especialización en Cirugía Bucal e Implantología. Facultad de Odontología. Universidad Complutense de Madrid (UCM).
Sánchez-Labrador, Luis
Profesor colaborador honorífico. Departamento de Especialidades Clínicas Odontológicas. Universidad Complutense de Madrid (UCM).
López-Quiles Martínez, Juan
Profesor contratado doctor. Director del Posgrado de Especialización en Cirugía Bucal e Implantología. Facultad de Odontología. Universidad Complutense de Madrid (UCM).