Científica Dental: abril 2021 (edición exclusiva online)
Revisión bibliográfica
Taheri RB, Planells del Pozo P. Relación entre problemas respiratorios en la infancia y las alteraciones del esmalte. Revisión sistemática. Cient. Dent. 2021; 18; 2; 111-118
Relación entre problemas respiratorios en la infancia y las alteraciones del esmalte. Revisión sistemática
El objetivo de esta revisión sistemática fue recoger los estudios que evalúan la relación entre problemas respiratorios en la infancia y el riesgo de desarrollar alteraciones del esmalte. Se realizó una búsqueda sistemática de la literatura publicada hasta el 1 de febrero de 2021 en las siguientes bases de datos: Pubmed, Scoupus, Web of Science y Cochrane. De un total de 173 artículos, 20 artículos cumplían los criterios de inclusión. Un total de 16 artículos estudiaron la relación con alteraciones respiratorias y otros 4 artículos la relación con fármacos frecuentemente administrados en estas patologías. Los estudios analizados muestran que los pacientes que han padecido asma u otras enfermedades respiratorias en los primeros años de vida tienen mayor riesgo de desarrollar alteraciones del esmalte, síndrome incisivo molar y/o segundo molar temporal hipomineralizado. Además, los fármacos empleados para su tratamiento también pueden ser un posible factor etiopatogénico de estas patologías. Debido a la limitada evidencia científica disponible, es necesaria la realización de nuevos estudios clínicos aleatorizados para confirmar la hipótesis planteada.
The aim of this systematic review was to collect studies that evaluate the relationship between respiratory problems in childhood and the risk of developing enamel disorders. A systematic search of the literature published up to 1 February 2021 was conducted in the following databases: Pubmed, Scoupus, Web of Science and Cochrane. Out of a total of 173 articles, 20 articles met the inclusion criteria. A total of 16 articles studied the relationship with respiratory disorders and a further 4 articles studied the relationship with drugs frequently administered in these pathologies. The studies analysed show that patients who have suffered from asthma or other respiratory diseases in their early years of life have a higher risk of developing enamel disorders, hypomineralised incisor-molar and/ or second primary molar syndrome. In addition, the drugs used for their treatment may also be a possible etiopathogenic factor in these pathologies. Due to the limited scientific evidence available, new randomised clinical studies are needed to confirm the proposed hypothesis.
El esmalte dental es un tejido acelular altamente mineralizado y único por sus propiedades bioquímicas. Está formado por un proceso de biomineralización mediado por unas células de origen ectodérmico denominadas ameloblastos. El proceso se desarrolla en un compartimento aislado del órgano del esmalte, donde al ameloblasto secreta una matriz extracelular compuesta por numerosas enzimas y proteínas (principalmente amelogenina) fundamentales en el desarrollo del esmalte. El proceso de secreción está continuamente monitorizado, manteniendo un equilibrio en las condiciones bioquímicas necesarias para formar el esmalte. Este proceso está dividido en múltiples etapas descritas por Reith en 1970: secreción de una matriz orgánica, nucleación cristalina, elongación cristalina, eliminación de la matriz orgánica y maduración cristalina. Como consecuencia, se forma una estructura cristalina de hidroxiapatita organizada en prismas que se orientan desde el límite amelodentinario a la superficie del diente1,2.
Aunque este proceso está estrictamente controlado genéticamente, el ameloblasto es una célula muy sensible a cambios ambientales y genéticos3-5. Alteraciones en las primeras etapas de secreción producen una alteración de la longitud de los cristales de hidroxiapatita, manifestándose como un esmalte patológicamente delgado o hipoplásico. Sin embargo, alteraciones de las etapas de maduración producen una alteración en la deposición del contenido mineral produciendo un esmalte hipomaduro o hipomineralizado6.
La amelogénesis imperfecta es una condición que cursa con alteraciones del esmalte, así como otros cambios morfológicos a nivel corporal debido a una causa genética2 . Además, existen síndromes médicos hereditarios que producen estas alteraciones como son el síndrome de Usher o el síndrome de Ellis Van Creveld7 .
Este delicado proceso de mineralización también puede verse alterado por factores locales y sistémicos8 . Weerheijm y cols.9 en 2001 describieron por primera vez el término de Síndrome Incisivo Molar (HIM) como una alteración adquirida del esmalte de al menos un primer molar permanente con posible afectación de incisivos permanentes. Fue en el año 2003, en la reunión de la Academia Europea de Odontopediatría (EAPD), cuando esta patología fue aceptada10. Esta patología puede manifestarse en forma de lesiones en el esmalte de tipo cuantitativas (hipoplasias) o cualitativas (opacidades). Posteriormente, Elfrink11 en 2008 definió el término Segundo Molar Temporal Hipomineralizado (HSPM) como una alteración idiopática de 1 a 4 segundos molares temporales.
La etiología de estas alteraciones del esmalte sigue siendo incierta, a pesar de haber estudios que tratan de clarificar las posibles causas etiológicas y la relación con patologías médicas en etapas prenatales, neonatales y postnatales6,12. El objetivo de esta revisión sistemática fue recoger los estudios que evalúan la relación entre problemas respiratorios en la infancia y el desarrollo de alteraciones del esmalte.
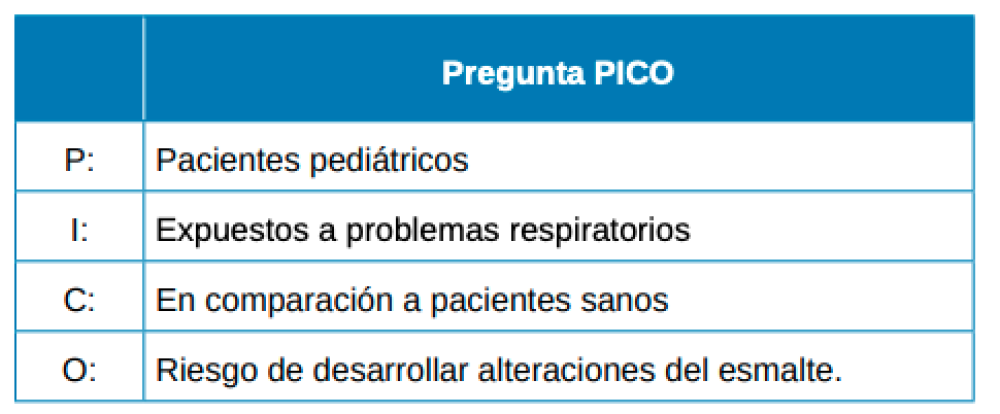
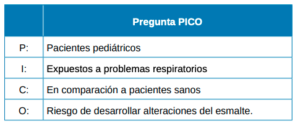
Esta revisión sistemática se realizó siguiendo las guías PRISMA para el desarrollo de revisiones sistemáticas13. Con el objetivo planteado se buscó responder a la siguiente pregunta PICO (Figura 1). ¿En pacientes pediátricos con problemas respiratorios, hay mayor riesgo de desarrollar alteraciones del esmalte frente a pacientes sanos?
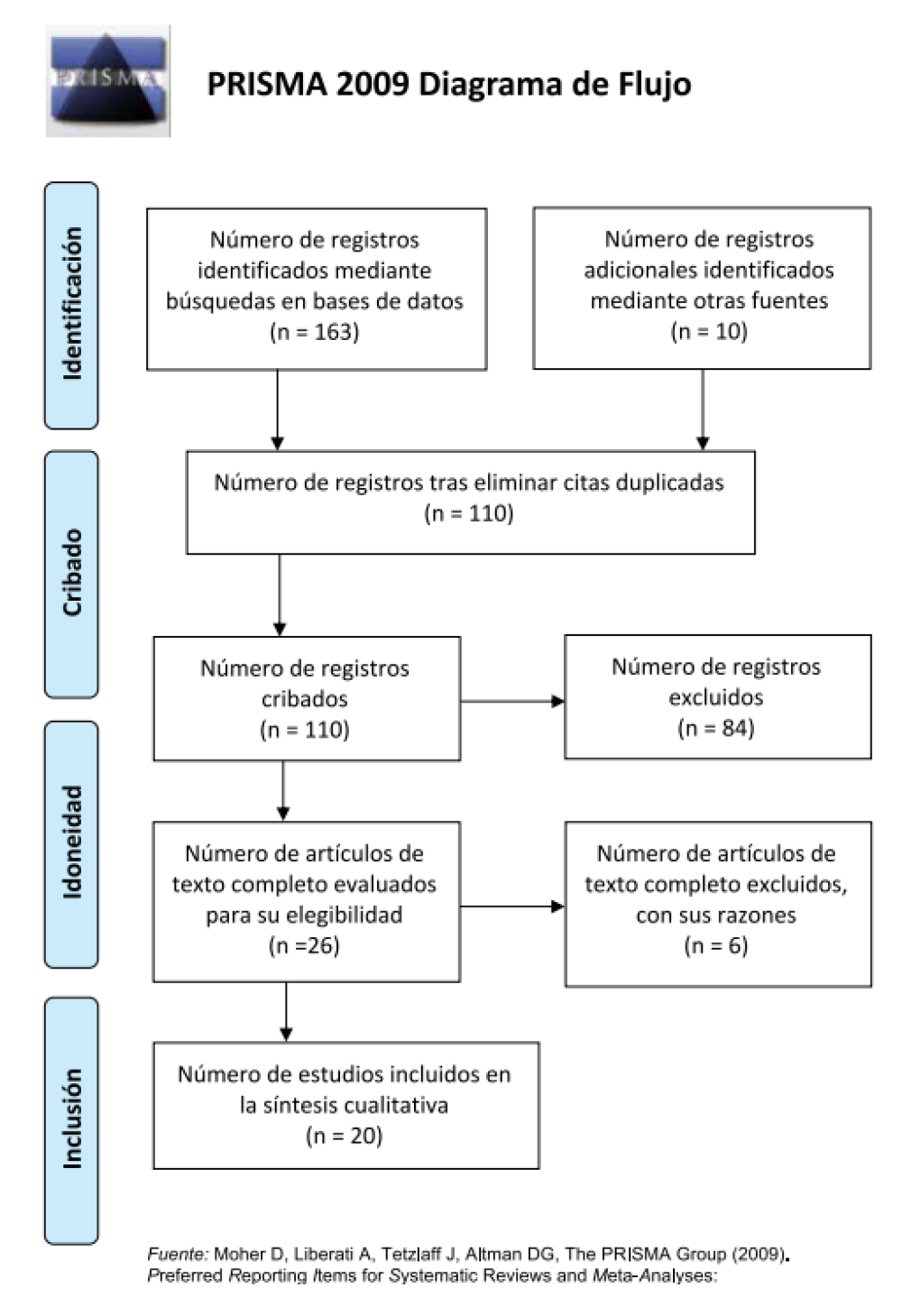
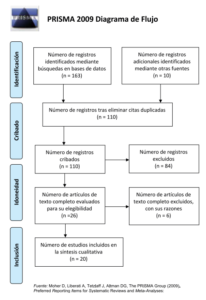
Se realizó una búsqueda de la literatura publicada hasta el 1 de febrero de 2021 en las siguientes bases de datos: Pubmed, Scoupus, Web of Science y Cochrane. La estrategia de búsqueda fue adaptada a cada uno de los buscadores y los resultados obtenidos fueron detallados en forma de diagrama de flujo (Figura 2). A su vez, se analizó de forma manual el listado de referencias de los artículos seleccionados para identificar posibles estudios relevantes que pudieran haber sido omitidos en la búsqueda antes mencionada.
Los criterios de inclusión fueron: artículos que evalúan la relación entre problemas respiratorios y alteraciones del esmalte referidos a estudios en humanos y publicados en cualquier idioma. Los criterios de exclusión fueron: estudios en animales, estudios en pacientes con síndromes congénitos (fibrosis quística, amelogénesis imperfecta, síndrome de Usher o síndrome de Ellis Van Creveld), alteraciones del esmalte por fluorosis, alteraciones del esmalte por uso de tetraciclinas, editoriales, cartas al editor y publicaciones cuya temática no estuviera relacionada con el tema de la revisión.
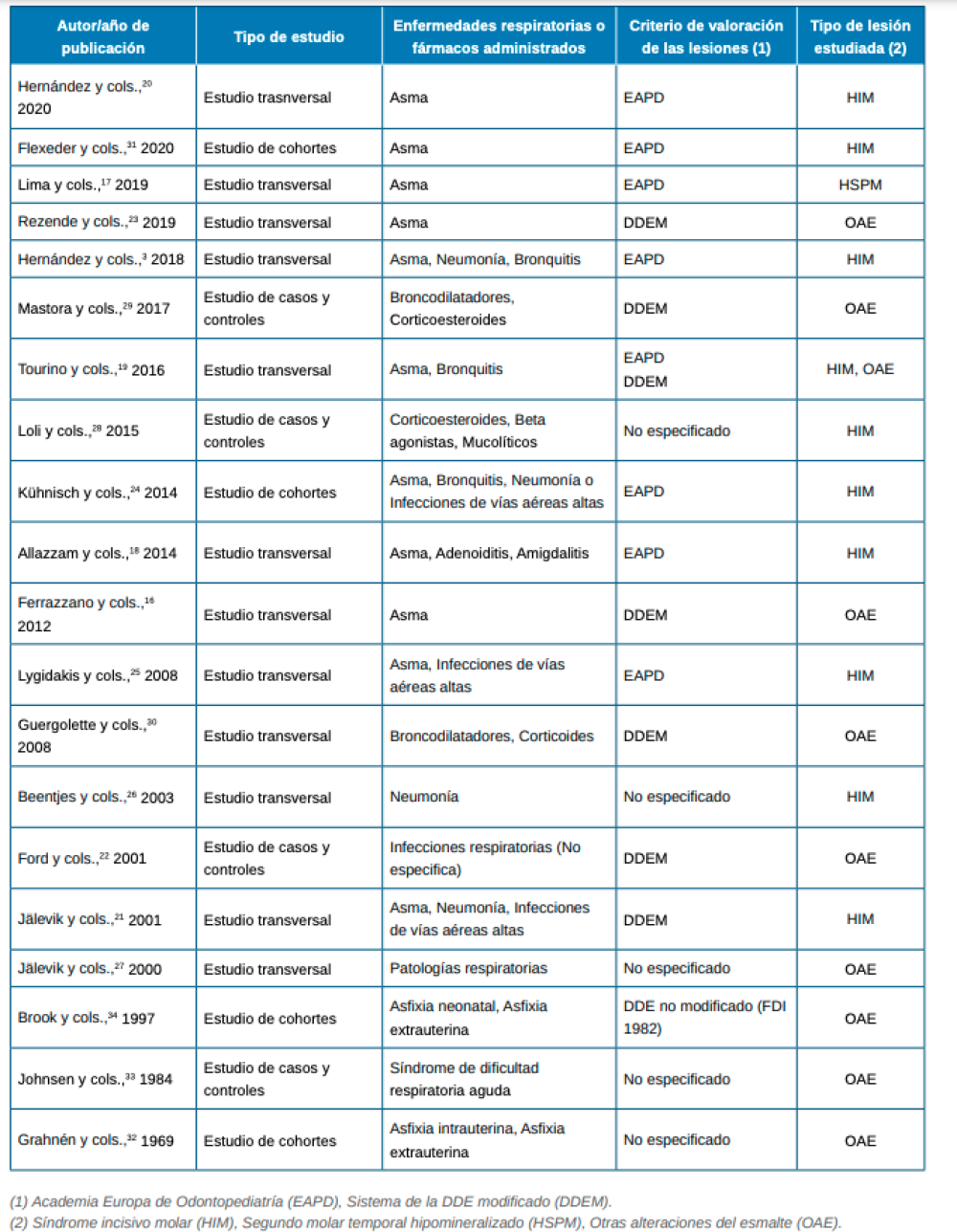
De un total de 173 artículos, se seleccionaron 20 artículos que cumplieron con los criterios de inclusión y exclusión (Tabla 1). Del total de artículos incluidos, 5 valoraron la relación con el asma, 5 la relación con otros problemas respiratorias y 4 valoraron ambos factores. El efecto de los fármacos empleados para tratar estas patologías respiratorias fue analizado en 4 artículos. Por último, se incluyeron 2 estudios que valoraron el efecto de la asfixia intrauterina, asfixia extrauterina y/o síndrome de dificultad respiratoria aguda en el desarrollo de alteraciones del esmalte. De estos artículos, 12 eran estudios transversales, 4 de casos y controles y 4 de cohortes.
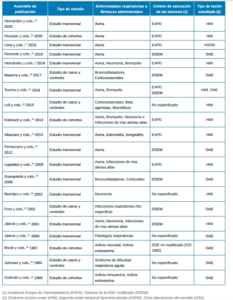
Existen múltiples criterios para valorar clínicamente la presencia de alteraciones del esmalte, HIM y HSPM. El sistema de la DDE modificado fue el más empleado (6 artículos). Este criterio fue introducido por Clarkson y O´Mullane14 en 1989. Otros 7 estudios utilizaron el sistema propuesto por la Academia Europea de Odontopediatría (EAPD)8 . Un único estudio empleó el sistema DDE no modificado (FDI 1982), otros 5 estudios no especificaron el método utilizado y un único estudio empleó tanto el sistema la DDE modificado como el de la EAPD.
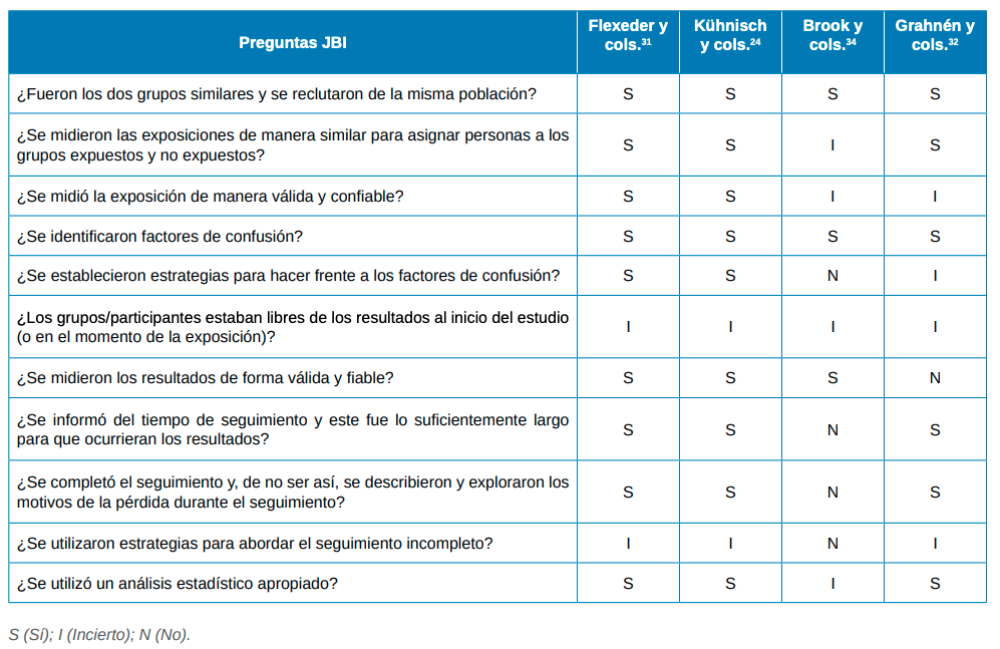
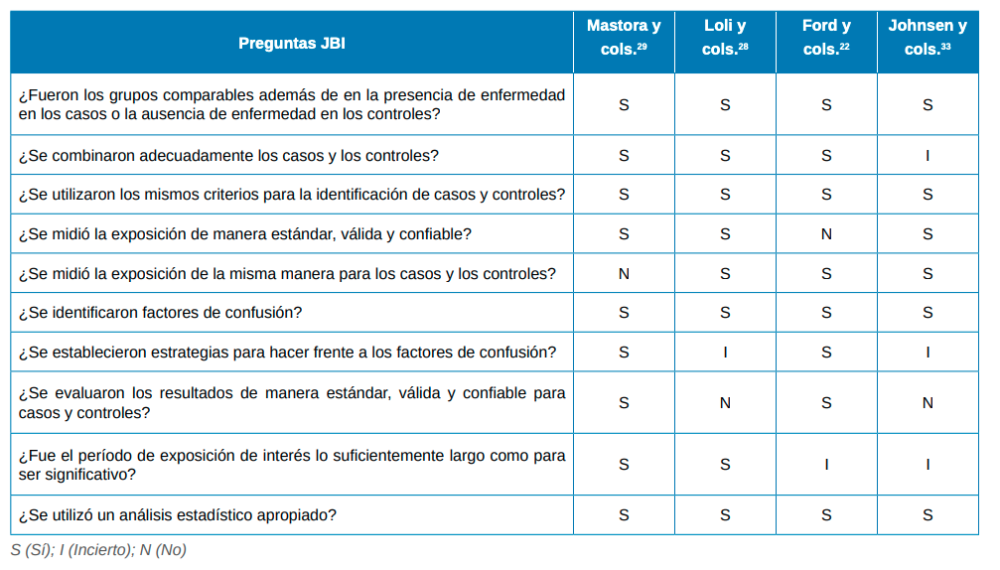
El riesgo de sesgo fue evaluado mediante la herramienta de evaluación del Instituto Joanna Briggs (JBI)15. Esta herramienta fue aplicada a los estudios de cohortes (Tabla 2) y de casos y controles (Tabla 3).
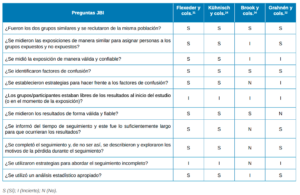
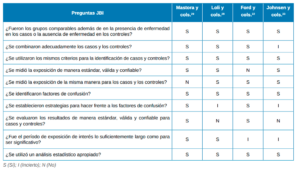
y controles.
Relación con asma
La prevalencia del asma ha aumentado en las últimas dos décadas en la gran mayoría de países siendo diagnosticada principalmente en la infancia. Debido al incremento de casos, existen guías para un correcto diagnóstico y tratamiento según la severidad de esta. Además, la repercusión del asma en la salud oral (caries y enfermedades periodontales) está siendo estudiada16.
Lima y cols.17 observaron en una población de Brasil, una prevalencia 69% mayor de HSPM en pacientes que habían padecido asma con respecto a pacientes sanos (p=0,95). Allazzam y cols.18 observaron que existía una mayor prevalencia de HIM en pacientes infantiles asmáticos de un hospital en Arabia Saudí en comparación con pacientes sin asma (p<0.001). Tourino y cols.19 también observaron esta relación si el asma se producía durante los primeros 4 años del paciente.
Hernández y cols.20 en 2020 analizaron en un estudio transversal las historias clínicas de 102 pacientes infantiles de Barcelona con HIM. Se observó una relación estadísticamente significativa entre HIM y presencia de asma (p≤0.05). Estos datos son respaldados por el estudio de Hernández y cols.3 , Jälevik y cols.21 y Ford y cols.22 que también encontraron una relación estadísticamente significativa entre el asma y alteraciones del esmalte.
Sin embargo, otros trabajos muestran que no hay una prevalencia estadísticamente significativa mayor de alteraciones del esmalte en pacientes con asma en comparación con pacientes sin asma. Rezende y cols.23 observaron una prevalencia del 63,2% de alteraciones del esmalte (de todos los dientes temporales y permanentes erupcionados) en pacientes de 6 a 12 años asmáticos frente a una prevalencia del 48,2% en no asmáticos. Resultados similares fueron obtenidos por Ferrazzano y cols.16 en una población de Nápoles (Italia).
Relación con otros problemas respiratorios
La relación con otras patologías respiratorias como la bronquitis, neumonía, adenoiditis, amigdalitis e infecciones de vías áreas ha sido estudiada.
Un estudio de cohortes publicado por Kühnisch y cols.24 demostró que pacientes con asma, bronquitis, neumonía o infecciones de vías aéreas altas antes de los 4 años presentaban mayor probabilidad de presentar alteraciones del esmalte en al menos un molar e incisivo permanente (OR=2,43) (p=0,95). El único estudio de casos y controles que valora esta relación demostró que pacientes infantiles en Australia con infecciones respiratorias (sin especificar) entre los 0 y 3 años presentaban un mayor riesgo de padecer alteraciones del esmalte frente a controles (RR=5,39) (p<0,001). Estos pacientes presentaron lesiones hipoplásicas u opacidades y ninguno recibió agentes fluorizantes durante su infancia22.
Lygidakis y cols.25 estudiaron la presencia de diferentes enfermedades prenatales, perinatales y postnatales en un grupo de niños con HIM. Un 87% de los niños con HIM presentaban problemas médicos. Sin embargo, solo el 18,9% de los pacientes sin alteraciones del esmalte presentaban otras enfermedades. Además, observaron una relación entre infecciones en vías áreas altas (sin especificar) y HIM.
Resultados similares fueron obtenidos por Beentjes y cols.26 en una población infantil de Países Bajos, encontrando mayor prevalencia de neumonía en pacientes con HIM que en pacientes sanos (p=0.027). Otros estudios también observaron esta relación3,18,19.21.
En contraposición, un único estudio por Jälevik y cols.27 observaron que no existía relación entre alteraciones del esmalte y condiciones médicas del aparato respiratorio en los dos primeros años de vida de un grupo de niños de 6 a 8 años, que fueron encuestados tras recibir extracciones dentarias de sus primeros molares por hipomineralizaciones severas.
Relación con uso de fármacos
El tratamiento de estas patologías suele ser mediante fármacos. Los comúnmente administrados son: corticoesteroides, broncodilatadores, beta agonistas y/o mucolíticos. El modo de administración más frecuente es en forma de aerosol28.
Mastora y cols.29 realizaron un estudio de casos y controles en una población infantil de Atenas (Grecia). Observaron en el grupo caso (niños bajo tratamiento de corticoides o broncodilatadores orales) una mayor probabilidad de presencia de alteraciones del esmalte frente al grupo de pacientes control (OR=5,6) (p < 0,05). Las lesiones fueron encontradas con mayor frecuencia en los molares permanentes mandibulares, sobre todo en mujeres (3,6 veces más frecuente que en hombres).
Loli y cols.28 observaron que existía mayor probabilidad de HIM en pacientes que usaban terapia de aerosoles (corticoesteroides, beta agonistas y mucolíticos) más de 15 veces al año frente a los que usaban estas terapias menos o igual a 15 veces al año (OR=3.19) (p>0,001). Asimismo, los pacientes diagnosticados de enfermedades respiratorias (faringitis, asma bronquiolitis y bronquitis) con HIM habían iniciado antes el tratamiento mediante aerosoles que los no afectados por HIM. Los pacientes que se enjuagaban la boca después de usar el fármaco tenían menor presencia de estas lesiones dentarias (p<0,01).
Guergolette y cols.30 también encontraron mayor prevalencia de lesiones del esmalte en pacientes asmáticos (p=0,0001). Sin embargo, afirmaron que no había una correlación con la edad de inicio del tratamiento y la frecuencia de este. Además, se observó una relación estadísticamente significativa entre la severidad del asma y ocurrencia de alteraciones del esmalte.
Flexeder y cols.31 llevaron al cabo un estudio de cohortes en una población alemana que reflejó resultados semejantes. Desde el nacimiento hasta los 10 años no se observó una relación estadísticamente significativa entre la presencia de asma (independientemente del uso o no de fármacos) y alteraciones del esmalte. Sin embargo, tras 15 años, sí se observó esta relación en asmáticos que no consumían fármacos (OR=2,56) (p=0,043).
Relación con asfixia intrauterina y asfixia extrauterina
La asfixia intrauterina y asfixia extrauterina son afectaciones en las que se produce una reducción del aporte del oxígeno al feto, pudiendo estar asociada a un parto prematuro.
Grahnén y cols.32 valoraron la relación entre la hipoxia y alteraciones del esmalte. Estudiaron un grupo de pacientes que había sufrido asfixia intrauterina y/o extrauterina, obteniendo estos una mayor prevalencia de alteraciones del esmalte en comparación con un grupo control (p<0,05). Johnsen y cols.33 encontraron que existía una relación estadísticamente significativa entre el síndrome de dificultad respiratoria aguda en niños nacidos pretérmino y alteraciones del esmalte (p<0,01).
Brook y cols.34 realizaron un estudio sobre un grupo de cohortes obteniendo una relación estadísticamente significativa entre problemas en la ventilación debido a un parto prematuro (necesidad de intubación, ventilación o signos de asfixia extrauterina) y presencia de alteraciones del esmalte. Los pacientes con uso de ventilador tenían mayor prevalencia de alteraciones del esmalte que los pacientes sin uso de ventilador (p=0,001).
Aunque se han estudiado numerosos factores predisponentes, la etiología de las alteraciones del esmalte sigue siendo incierta35. El uso de fármacos por parte de la madre, enfermedades durante el embarazo, estrés maternal, parto prematuro, bajo peso al nacer, fiebre, infecciones del oído y medicación durante la infancia han sido estudiados como posibles factores etiológicos6,12,25,36.
Estas condiciones médicas pueden instaurarse en diferentes momentos de la vida del paciente. Lygidakis y cols.25 observaron en una muestra de pacientes con HIM que un 8,6% tenían condiciones médicas prenatales, un 33,6% perinatales y un 33.9% postnatales. Otros estudios han observado que pacientes con problemas de salud en los primeros años de vida tienen una mayor prevalencia de alteraciones del esmalte3,19,21.
La Academia Europea de Odontopediatría (EAPD) establece que es probable que no exista un único factor etiológico sino diversos factores etiológicos que puedan aumentar el riesgo de padecer alteraciones del esmalte. Adicionalmente, resalta la necesidad de basar estudios clínicos en estudios previos experimentales en laboratorio para conocer mejor la etiopatogenia de esta enfermedad8 .
Existen múltiples estudios in vitro que valoran el efecto de la hipoxia en la función de los ameloblastos. Se ha observado en una línea celular derivada de los ameloblastos, el efecto de la hipoxia en la secreción de fosfatasa alcalina, lactasa deshidrogenasa, citoquinas e interleuquinas; todas fundamentales en el desarrollo adecuado de la estructura del esmalte. Tras 24 y 48 horas de condiciones de oxígeno del 1%, se observó una alteración en el meticuloso proceso de expresión y procesamiento de proteínas y un aumento de la secreción de factores proinflamatorios37.
Modelos en animales también han permitido observar el efecto de la hipoxia en el desarrollo del esmalte. Se observaron alteraciones del esmalte en ratas que habían sufrido hipoxia durante el vigésimo día de gestación38. Sin embargo, un estudio también en ratas por Baumgardner y cols.39 refirió que la exposición a corto plazo (durante 24 horas) de hipoxia no producía alteraciones de la función de los ameloblastos.
Tal y como se puede apreciar, los estudios en humanos no presentan resultados concluyentes que nos permitan confirmar con certeza la relación. El problema respiratorio más estudiado como factor etiológico de alteraciones del esmalte ha sido el asma. Además, otras enfermedades han sido valoradas (bronquitis, neumonía, adenoiditis amigdalitis e infecciones de vías áreas).
Aunque la gran mayoría de estudios presentan una relación estadísticamente significativa entre alteraciones del esmalte y enfermedades respiratorias, 12 de ellos presentan un grado de evidencia bajo al tratarse de estudios trasversales3,16-19,23,25-27,30,40. Solo 4 artículos de casos y controles y 4 artículos de cohortes fueron encontrados. Todos los artículos incluidos presentaban un riesgo de sesgo, destacando en los estudios de cohortes la falta de conocimiento de la presencia de la enfermedad o predisposición a esta antes de la exposición al factor estudiado. Cabe destacar que 2 de los estudios de cohortes fueron realizados sobre una misma cohorte de niños alemanes24,32.
Además, existen grandes variaciones en cuanto a prevalencia de alteraciones del esmalte en distintas poblaciones estudiadas. Los estudios incluidos fueron realizados principalmente en Europa y en Sudamérica. Lygidakis y cols.25 en una muestra de pacientes pediátricos de un centro comunitario dental de Atenas (Grecia), encontraron una prevalencia del 10,2% de alteraciones del esmalte. Los datos en España son similares, obteniendo un 7,9% de prevalencia en una población infantil de Barcelona3 .
La prevalencia de las alteraciones del esmalte coloca a este fenómeno como un problema global de salud oral. Por ello, parece fundamental la necesidad de conocer los factores de riesgo que pueden influir en la patogénesis de la enfermedad.
Los estudios analizados en esta revisión sistemática muestran que distintos problemas respiratorios en la infancia y los fármacos empleados para su tratamiento pueden ser un posible factor etiopatogénico de las alteraciones del esmalte, HIM y HSPM. La posible relación entre alteraciones del esmalte y problemas respiratorios en la infancia resaltan la importancia de realizar una correcta anamnesis e historia clínica en pacientes odontopediátricos.
En nuestra opinión, debido a la escasez de trabajos al respecto y la baja evidencia científica disponible, es necesaria la realización de nuevos estudios clínicos aleatorizados para confirmar la hipótesis planteada.
Simmer JP, Fincham AG. Molecular mechanisms of dental enamel formation. Crit Rev Oral Biol Med 1995; 6: 84-108.
Slavkin HC. Molecular determinants of tooth development: a review. Crit Rev Oral Biol Med 1990; 1: 1-16.
Hernández M, Boj J, Espasa E, Planells P, Peretz B. Molar-incisor hypomineralization: positive correlation with atopic dermatitis and food allergies. J Clin Pediatr Dent 2018; 42: 344-8.
Jeremias F, Koruyucu M, Küchler EC, Bayram M, Tuna EB, Deeley K. Genes expressed in dental enamel development are associated with molar-incisor hypomineralization. Arch Oral Biol 2013; 58: 1434-42.
Paine ML, Zhu DH, Luo W, Bringas P Jr, Goldberg M, White SN, Lei YP, Sarikaya M, Fong HK, Snead ML. Enamel biomineralization defects result from alterations to amelogenin self-assembly. J Struct Biol 2000; 132: 191-200.
Alaluusua S. Aetiology of molar-incisor hypomineralisation: a systematic review. Eur Arch Paediatr Dent 2010; 11: 53-8.
Salanitri S, Seow W. Developmental enamel defects in the primary dentition: aetiology and clinical management. Aust Dent J 2013; 58: 133-40.
Lygidakis NA, Wong F, Jälevik B, Vierrou AM, Alaluusua S, Espelid I. Best clinical practice guidance for clinicians dealing with children presenting with molarincisor-hypomineralisation (MIH): an EAPD policy document. Eur Arch Paediatr Dent 2010; 11: 75-81.
Weerheijm KL, Jälevik B, Alaluusua S. Molar–incisor hypomineralisation. Caries Res 2001; 35: 390-1.
Weerheijm KL, Mejàre I. Molar incisor hypomineralization: a questionnaire inventory of its occurrence in member countries of the European Academy of Paediatric Dentistry (EAPD). Int J Paediatr Dent 2003; 13: 411-6.
Elfrink MEC, Schuller AA, Weerheijm KL, Veerkamp JSJ. Hypomineralized second primary molars: prevalence data in Dutch 5-year-olds. Caries Res 2008; 42: 282-5.
Silva MJ, Scurrah KJ, Craig JM, Manton DJ, Kilpatrick N. Etiology of molar incisor hypomineralization – a systematic review. Community Dent Oral Epidemiol 2016; 44: 342-53.
Moher D, Liberati A, Tetzlaff J, Altman DG, Group TP. Preferred reporting items for systematic reviews and metaanalyses: The PRISMA Statement. PLOS Med 2009; 6: 1-6.
Clarkson J, O’Mullane D. A modified DDE index for use in epidemiological studies of enamel defects. J Dent Res 1989; 68: 445-50.
Moola S, Munn Z, Tufanaru C, Aromataris E, Sears K, Sfetcu R, Currie M, Qureshi R, Mattis P, Lisy K, Mu P-F. Chapter 7: systematic reviews of etiology and risk. En: Aromataris E, Munn Z (Editors). Joanna Briggs Institute Reviewer’s Manual. The Joanna Briggs Institute, 2017.
Ferrazzano GF, Sangianantoni G, Cantile T, Amato I, Ingenito A, Noschese P. Dental health in asthmatic children: a south Italy study. J Dent Child Chic 2012; 79: 170-5.
Lima LRS, Pereira AS, de Moura MS, Lima CCB, Paiva SM, Moura L de FA de D. Preterm birth and asthma is associated with hypomineralized second primary molars in pre-schoolers: a population-based study. Int J Paediatr Dent 2020; 30: 193- 201.
Allazzam SM, Alaki SM, El Meligy OAS. Molar incisor hypomineralization, prevalence, and etiology. Int J Dent 2014; 1-8.
Tourino LFPG, Corrêa-Faria P, Ferreira RC, Bendo CB, Zarzar PM, Vale MP. Association between molar incisor hypomineralization in schoolchildren and both prenatal and postnatal factors: a population-based study. PLOS ONE 2016;11.
Hernández M, Mendioroz J. Hipomineralización incisivo-molar y marcha alérgica. ¿Un camino hacia la luz? Comorbilidades atópicas e hipomineralización incisivo-molar. Odontol Pediátr 2020; 28: 125-32.
Jälevik B, Norén JG, Klingberg G, Barregård L. Etiologic factors influencing the prevalence of demarcated opacities in permanent first molars in a group of Swedish children. Eur J Oral Sci 2001; 109: 230-4.
Ford D, Seow WK, Kazoullis S, Holcombe T, Newman B. A controlled study of risk factors for enamel hypoplasia in the permanent dentition. Pediatr Dent 2009; 382-8.
Rezende G, Dos Santos NML, Stein C, Hilgert JB, Faustino-Silva DD. Asthma and oral changes in children: associated factors in a community of southern Brazil. Int J Paediatr Dent 2019; 29: 456-63.
Kühnisch J, Mach D, Thiering E, Brockow I, Hoffmann U, Neumann C. Respiratory diseases are associated with molarincisor hypomineralizations. Swiss Dent J 2014; 124: 286-93.
Lygidakis NA, Dimou G, Marinou D. Molar-Incisor-Hypomineralisation (MIH). A retrospective clinical study in Greek children. II. Possible medical aetiological factors. Eur Arch Paediatr Dent 2008; 9: 207-17.
Beentjes VE, Weerheijm KL, Groen HJ. Factors involved in the aetiology of molarincisor hypomineralisation (MIH). Eur J Paediatr Dent 2002; 3:9-13.
Jälevik BJ. Enamel hypomineralization of permanent first molars: a morphological study and survey of possible aetiological factors. Int J Paediatr Dent 2000; 12; 278-89.
Loli D, Costacurta M, Maturo P, Docimo R. Correlation between aerosol therapy in early childhood and molar incisor hypomineralisation. Eur J Paediatr Dent 2015; 16: 73-7.
Mastora A, Vadiakas G, Agouropoulos A, Gartagani-Panagiotopoulou P, Gemou Engesaeth V. Developmental defects of enamel in first permanent molars associated with use of asthma drugs in preschool aged children: a retrospective case-control study. Eur Arch Paediatr Dent 2017; 18: 105-11.
Guergolette RP, Dezan CC, Frossard WTG, Ferreira FB de A, Cerci Neto A, Fernandes KBP. Prevalence of developmental defects of enamel in children and adolescents with asthma. J Bras Pneumol 2009; 35:295-300.
Flexeder C, Kabary Hassan L, Standl M, Schulz H, Kühnisch J. Is there an association between asthma and dental caries and molar incisor hypomineralisation? Caries Res 2020; 54: 87-95.
Grahnén H, Sjölin S, Arwill T, Magnusson BO. Neonatal asphyxia and mineralisation defects of the primary teeth: I. A clinical investigation. Caries Res 1969; 3: 301-7.
Johnsen D, Krejci C, Hack M, Fanaroff A. Distribution of enamel defects and the association with respiratory distress in very low birthweight infants. J Dent Res 1984; 63: 59-64.
Brook AH, Fearne JM, Smith JM. Environmental causes of enamel defects. Ciba Found Symp 1997; 205: 212-21.
Small BW, Murray JJ. Enamel opacities: prevalence, classifications and aetiological considerations. J Dent 1978; 6: 33-42.
Fatturi AL, Wambier LM, Chibinski AC. A systematic review and meta-analysis of systemic exposure associated with molar incisor hypomineralization. Community Dent Oral Epidemiol 2019; 47: 407-15.
Sidaly R, Landin MA, Suo Z, Snead ML, Lyngstadaas SP, Reseland JE. Hypoxia increases the expression of enamel genes and cytokines in an ameloblastderived cell line. Eur J Oral Sci 2015; 123: 335-40.
Jr WFV, Elwood WK, Bebin J. The effect of maternal hypoxia upon fetal dental enamel. Henry Ford Hosp Med Bull 1959; 7: 94-101.
Baumgardner KR, Walton RE, Osborne JW, Born JL. Induced hypoxia in rat pulp and periapex demonstrated by 3H-misonidazole retention. J Dent Res 1996; 75: 1753-60.
Jälevik B. Enamel hypomineralization in permanent first molars. A clinical, histomorphological and biochemical study. Swed Dent J Suppl 2001;1-86.

Taheri, Ricardo Bahram
Estudiante de Odontología de Quinto Curso, Facultad de Odontología, Universidad Complutense de Madrid.
Planells del Pozo, Paloma
Profesora titular de Odontopediatría y directora del título propio de la Facultad de Odontología, Universidad Complutense de Madrid. Diploma de especialización en atención odontológica integrada en el niño con necesidades especiales.