Caso clínico
Ochoa Gómez, J. Sánchez Sánchez, R. Cabezas Mojón, J. Fernández Domínguez, M. Síndrome de Gorlin-Goltz; a propósito de un caso. Cient. Dent. 2020; 17; 1; 49-55
Síndrome de Gorlin-Goltz; a propósito de un caso
El síndrome de Gorlin-Goltz (SGG) es también conocido como síndrome névico basocelular o síndrome del carcinoma nevoide basocelular. Fue mencionado por primera vez en 1894 por los doctores Jarish y White y fue descrito en 1960 por Robert J. Gorlin. Es un raro trastorno autosómico dominante, ocasionado por una mutación sufrida en el gen Patched 1 (PTCH1) ubicado en el cromosoma 9q223 (este gen desempeña un papel en la supresión tumoral, la estructuración embrionaria y el ciclo celular), que se caracteriza por defectos en el desarrollo y por elevar de manera significativa la predisposición a padecer algún tipo de cáncer. Su prevalencia es variable según el país, pero está aceptada una media de 1:60.000 habitantes/ año, siendo la relación hombre/ mujer de 1: 0,621. El diagnóstico del SGG puede resultar complejo debido a la variabilidad en la expresividad del síndrome y en la edad de presentación. La manifestación más común en la cavidad oral son los queratoquistes, lesiones que aparecen hasta en el 90% de los pacientes.
Gorlin-Goltz Syndrome (GGS) is also known as basal cell nevus syndrome or nevoid basal cell carcinoma syndrome. It was first mentioned in 1894 by Doctors Jarish and White and described in 1960 by Robert J. Gorlin. It is a rare autosomal dominant condition, caused by a mutation suffered in the PTCH1 gene (Patched 1) located on chromosome 9q223 (this gene plays a role in tumour suppression, embryonic structuring and the cell cycle). It is characterised by defects in development and a significantly increased predisposition to suffering from some type of cancer. Its prevalence varies according to the country, but an average of 1 per 60,000 population/year is accepted, with the male/female ratio being 1:0.621. Diagnosing GGS can be complex due to the variability in the expressiveness of the syndrome and the age of presentation. The most common manifestation is the appearance of keratocysts in the oral cavity, which appear in up to 90% of patients.
El SGG es un trastorno autosómico dominante, ocasionado por una mutación del gen Patched 1 (PTCH1) ubicado en el cromosoma 9q223 (este gen desempeña un papel en la supresión tumoral, la estructuración embrionaria y el ciclo celular) el cual se caracteriza por defectos en el desarrollo y por elevar de manera significativa la predisposición a padecer algún tipo de cáncer. Las mutaciones en el gen PTCH1 dan como resultado la pérdida de control de varios genes, los cuales se sabe que juegan un papel importante en la organogénesis, la carcinogénesis y el proceso de odontogénesis, lo que resulta en el desarrollo del SGG1.
El SGG está caracterizado por el desarrollo de carcinomas basocelulares y queratoquistes odontogénicos en los maxilares, además de provocar malformaciones esqueletales. Debido a su alta predisposición al desarrollo de carcinomas basocelulares múltiples, es de extrema relevancia que se realice un diagnóstico precoz para poder contar con un pronóstico favorable. Se requiere de la atención de un equipo multidisciplinario, en el cual, el odontólogo también debe participar2. Pruvost-Balland y cols.,3 realizaron un estudio clínico y genético en 22 pacientes con SGG. Se identificaron mutaciones en el gen PTCH1 en 13 pacientes, de los cuales 6 fueron pacientes en los que estaban varios familiares afectados de diferentes generaciones, en 3 el SGG apareció de manera espontánea y en 4 pacientes, no fue posible determinar si había más familiares involucrados, por lo que resultó imposible determinar si puede haber una herencia genética del SGG. Su incidencia mundial se estima en 1 de cada 60.000 habitantes/ año, siendo la relación hombre/mujer de 1: 0,6214.
Paciente de sexo femenino de 9 años de edad, sin antecedentes médicos de interés, ni alergias, ni patologías, acude a Consultas Externas del Servicio de Cirugía Oral y Maxilofacial del Hospital Universitario Madrid-Montepríncipe referido de su odontólogo general, por presentar un quiste mandibular a nivel de incisivos inferiores. Tras la exploración física de la paciente se puede apreciar un abombamiento en vestibular a nivel de los incisivos inferiores y presentan una importante movilidad. Se solicita la prueba radiológica (radiografía panorámica), en la que se puede ver una imagen radiotransparente a nivel de los dientes 3.1, 3.2, 4.1 y 8.2. Además, se observa que el diente 4.2 aparece incluido en la basal mandibular. En base a lo anterior se decide solicitar una tomografía axial computerizada (TAC) y se ferulizan los dientes que presentan una importante movilidad. En el TAC es posible apreciar que el diente 4.2 aparece incluido, el 8.2 erupcionado y una imagen radiotransparente que alcanza los dientes 8.3 y 7.3, pero tanto la cortical
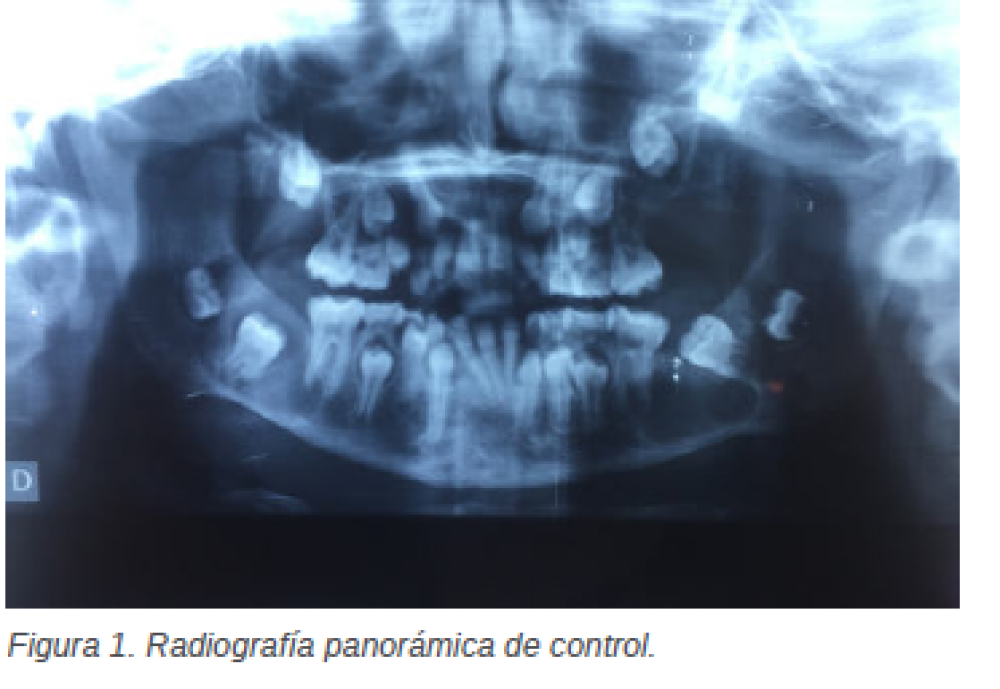
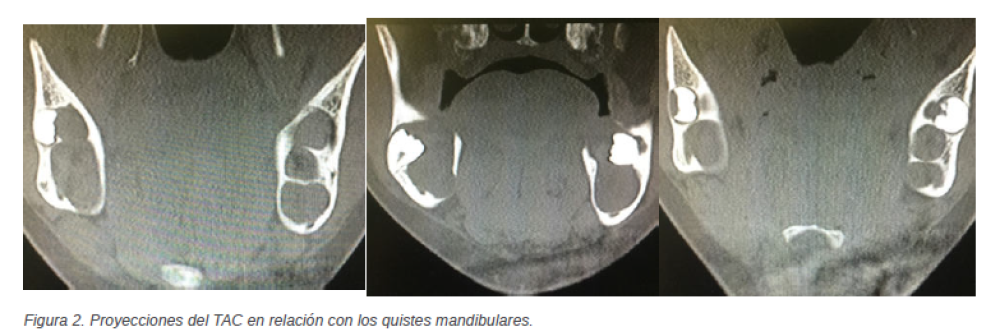
lingual como la vestibular están respetadas a pesar del abombamiento de las mismas. Con todo lo anteriormente mencionado, se decide realizar la intervención quirúrgica bajo anestesia general. Primera intervención quirúrgica Se realiza anestesia general que se refuerza con local. A continuación, se inicia la intervención con una incisión intrasulcular con descarga distal al 8.5 y 7.5, se despega el colgajo a espesor total y se realiza la ostectomía necesaria para llevar a cabo la quistectomía y el legrado de la cavidad quística, junto la extracción de los dientes 8.2 y 4.2 que aparecen de manera intraquística. A la semana siguiente se retira la sutura, a los 15 días se programa una revisión y se realiza una radiografía panorámica de control, en la que se puede apreciar el inicio de la curación ósea. Un mes después, gracias a la buena evolución y cicatrización de la paciente se observa una regeneración en la zona sinfisaria. Se cita para una revisión a los 6 meses para control radiográfico y valoración por el ortodoncista. A los 6 meses la paciente regresa a consulta para el control, y en la radiografía panorámica (Figura 1) puede observarse una nueva imagen radiotransparente en relación con el diente 3.7, junto a otra imagen rodeando al diente 4.7, por lo que se pide un nuevo TAC, para poder ver adecuadamente la regeneración mandibular, pero sobre todo para valorar y planificar la operación para eliminar la recién detectada imagen radiotransparente. Tras la realización del TAC (mediante cortes axiales con reconstrucciones en el plano coronal) se pueden identificar ambas lesiones en el tercer cuadrante y en el cuarto cuadrante (Figura 2). En relación con el tercer cuadrante se observa la inclusión del diente 3.7, que presenta inclinación mesial y contacta con la superficie cortical bucal de la mandíbula. Se trata de una lesión de aproximadamente 3,24cm x 2,1cm y que presenta un aspecto expansivo con áreas de marcado adelgazamiento cortical, está septado en su porción posterior en comunicación con quiste peridentario alrededor del molar 3.8. Ambas lesiones quísticas parecen de origen querático, lo que se tomará como primera opción diagnóstica. En el cuarto cuadrante se observa una lesión de similares características a las anteriormente descritas, que rodea al molar 4.7, tiene un diámetro de aproximadamente 2,3cm x 2,1cm, aparece septado posteriormente y con focos de lisis ósea y que conecta en sentido posterior con el tercer molar, 4.8 (Figura 2). Se prepara el preoperatorio y, una semana después, la paciente es intervenida quirúrgicamente.
Segunda intervención quirúrgica
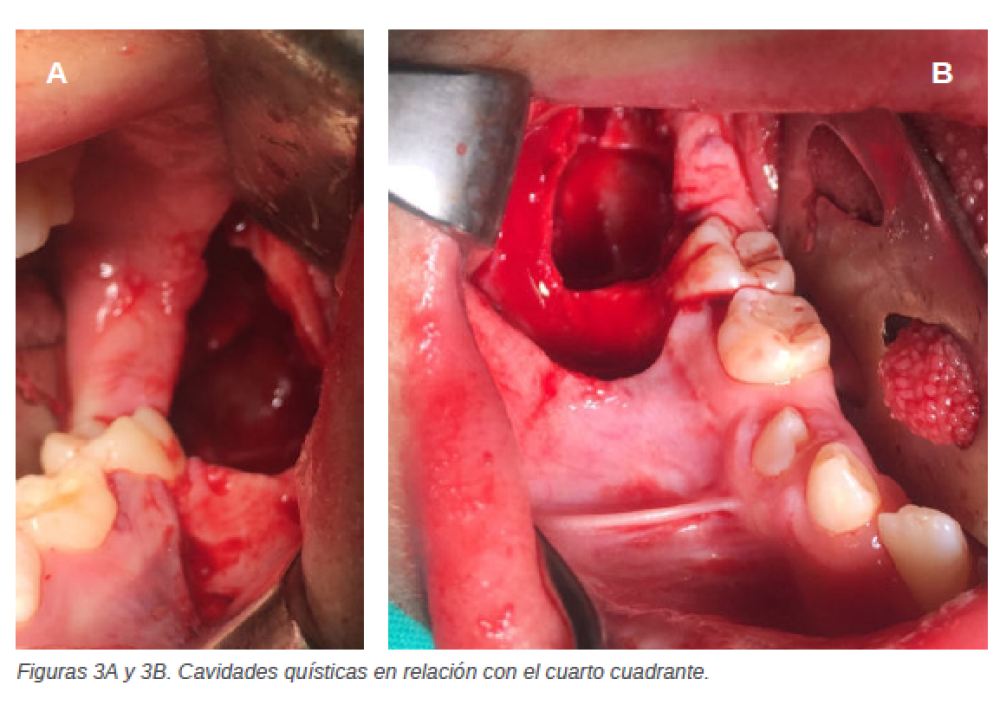
Se interviene nuevamente a la paciente bajo anestesia general y reforzando con anestesia local. Se realiza incisión y despegamiento del tercer cuadrante (Figura 3A) para poder extraer tanto los quistes como los dientes involucrados, se realiza hemostasia, se repone el colgajo mucoperióstico y se sutura con seda 3/0. Tras ello, se intervienen de igual manera el cuarto cuadrante (Figuras 3B) extirpando tanto los quistes como los dientes involucrados en ellos. Tras el estudio anatomopatológico los resultados definen los quistes macroscópicamente como varios fragmentos laminares grisáceos que agrupados miden 6.2cm x 5.3 cm. Y microscópicamente se determina que son lesiones quísticas con pared fibrosa con moderado infiltrado inflamatorio crónico de predominio plasmocitario y restos de Malassez. En superficie se observa revestimiento escamoso engrosado sin signos displásicos, aunque con queratinización, encontrándose material querático intraluminal, en ausencia de signos de malignidad. Se confirma así, el diagnóstico inicial de presunción con los resultados descritos por el equipo de anatomía patológica, siendo definidos como queratoquistes mandibulares. Ocho días después de la intervención quirúrgica, se realiza una nueva revisión. La paciente acude presentando un ligero edema y hematoma, apertura oral limitada, se insiste en la higiene oral, realizando una nueva revisión a los quince días con notable mejoría. A las tres semanas, la
paciente acude de urgencia por molestias, dolor que no localiza y fiebre. A la exploración física la apertura es normal, pero presenta edema en el cuarto cuadrante en la zona lingual mandibular,
sin elevación del suelo de boca. Se realiza el drenaje de la colección purulenta pautando amoxicilina con ácido clavulánico a dosis de 50 mg/ kg/ día durante una semana, y se le cita nuevamente en 4 días para control. A los 4 días, la paciente se muestra mejor sin dolor ni fiebre, y con una notable disminución del edema. A la exploración física muestra una apertura oral de 3 cm, no muestra edema ni elevación del suelo de boca, ni zonas susceptibles de drenaje. Se le recuerda e insiste en la importancia de la continuidad del tratamiento antibiótico y se le cita en una semana. Una semana después la paciente muestra una buena evolución, sin supuración en la cavidad oral y con la herida ya cicatrizada. No muestra dolor y presenta una adecuada tolerancia oral, por lo que se decide revisarla en 15 días para ver la evolución y realizar un nuevo TAC mandibular. Dos semanas después, se le realiza el TAC, en el cual se puede apreciar una buena evolución en la osificación, apareciendo nuevas lesiones quísticas a nivel de los dientes 1.3, 1.4, 1.5 y 1.6. Se decide remitir a la paciente al ortodoncista para planificar las extracciones. Tras ello, se programa la intervención quirúrgica bajo anestesia general en tres semanas.
Tercera intervención quirúrgica
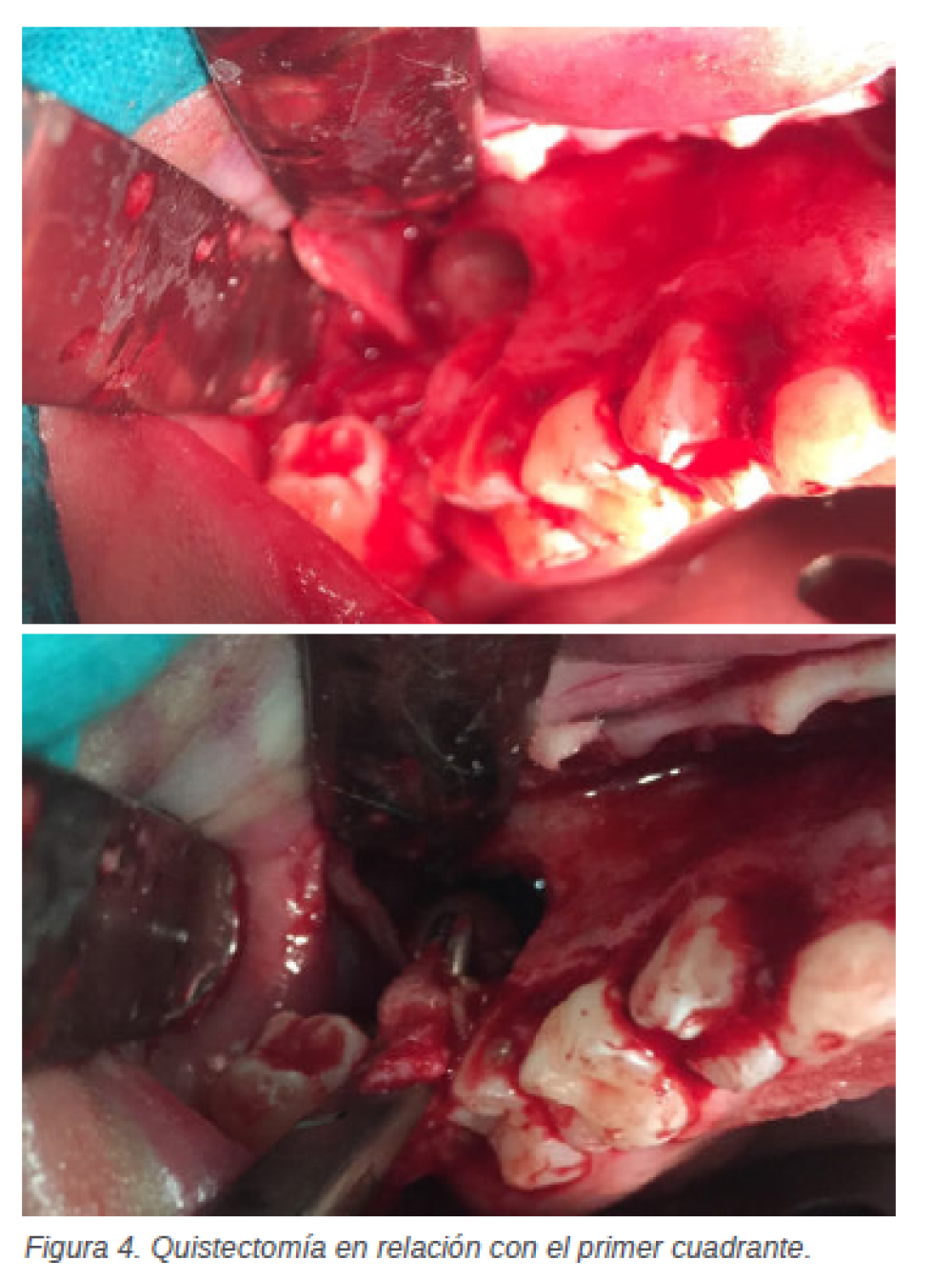
En esta intervención y tras la realización de una técnica anestésica general, se realiza una incisión de Neumann en el primer cuadrante, desde el diente 1.2 hasta el 1.6. A continuación, se realiza el despegamiento del colgajo a espesor total o mucoperióstico, para de esta manera poder realizar la ostectomía y posterior exéresis de la lesión en relación con el diente 1.6 y el germen del diente 1.7 que se muestra
incluido. Después, se realiza la quistectomía en relación con el diente 1.3, que presenta gran movilidad, y se efectúan las exodoncias de los dientes deciduos 5.2 y 5.3 (Figura 4). A continuación, se procede a la intervención del segundo cuadrante, realizando una incisión de Neumann englobando de los dientes 2.1 a 2.6. Tras ello se realiza el colgajo a espesor total, la ostectomía y la exéresis de la lesión en relación
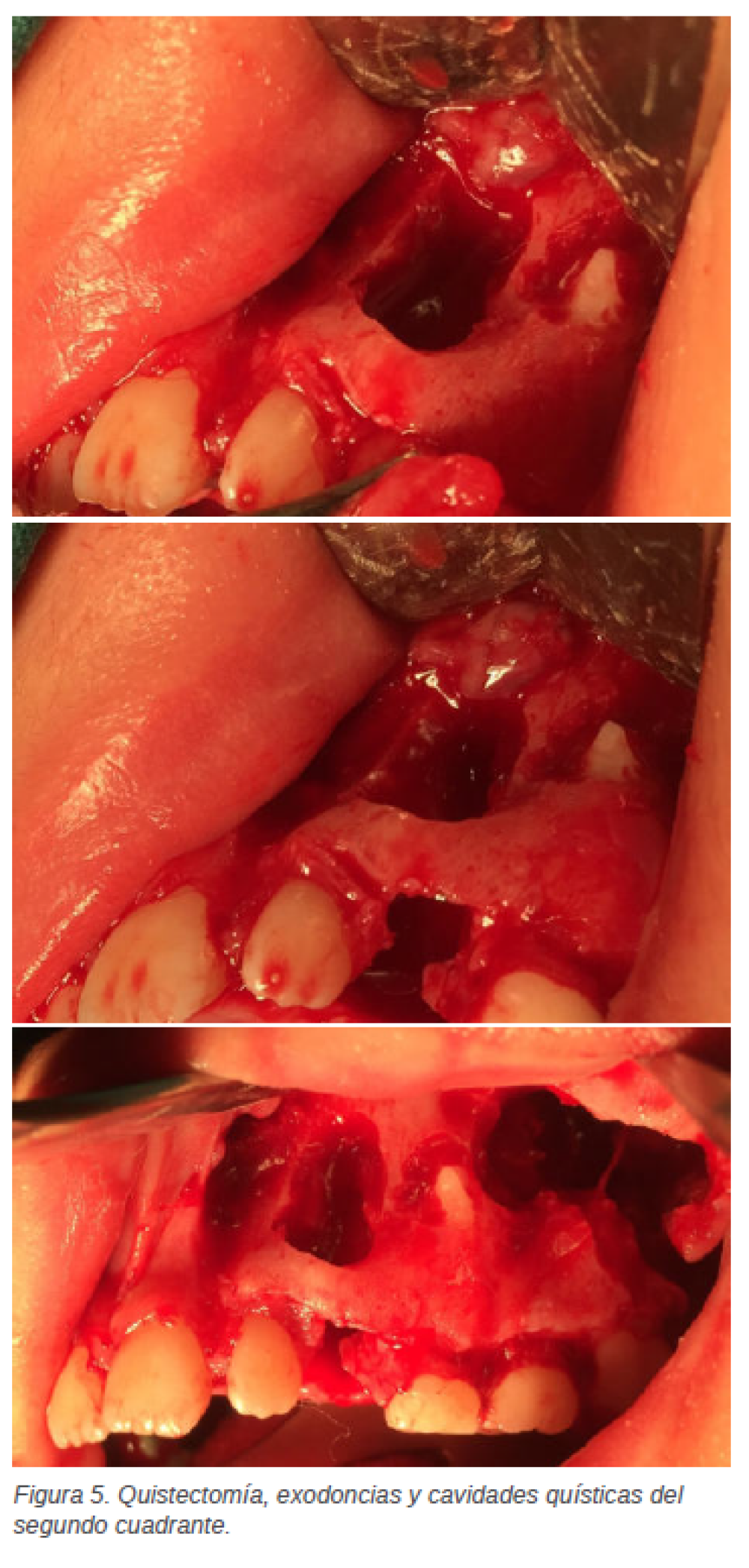
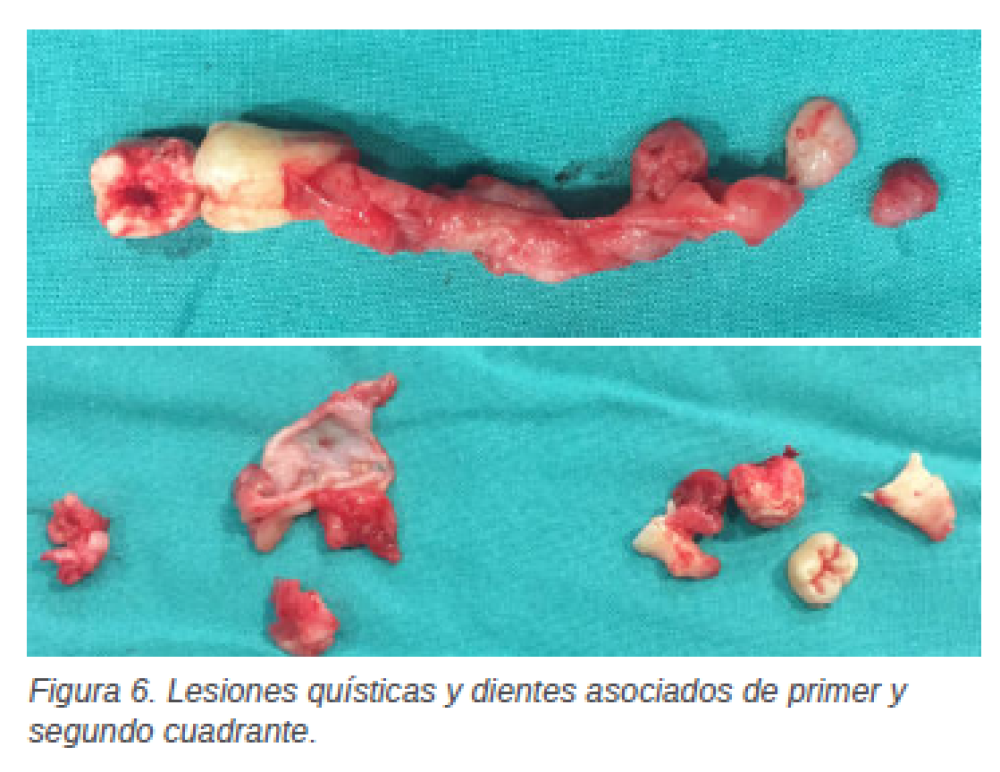
con el diente 2.6, la exodoncia del germen del diente 2.7, junto a la exodoncia del 2.5, previa odontosección y quistectomía, y, por último, se procede a la exodoncia de los dientes 2.3 y 6.2 (Figuras 5 y 6).
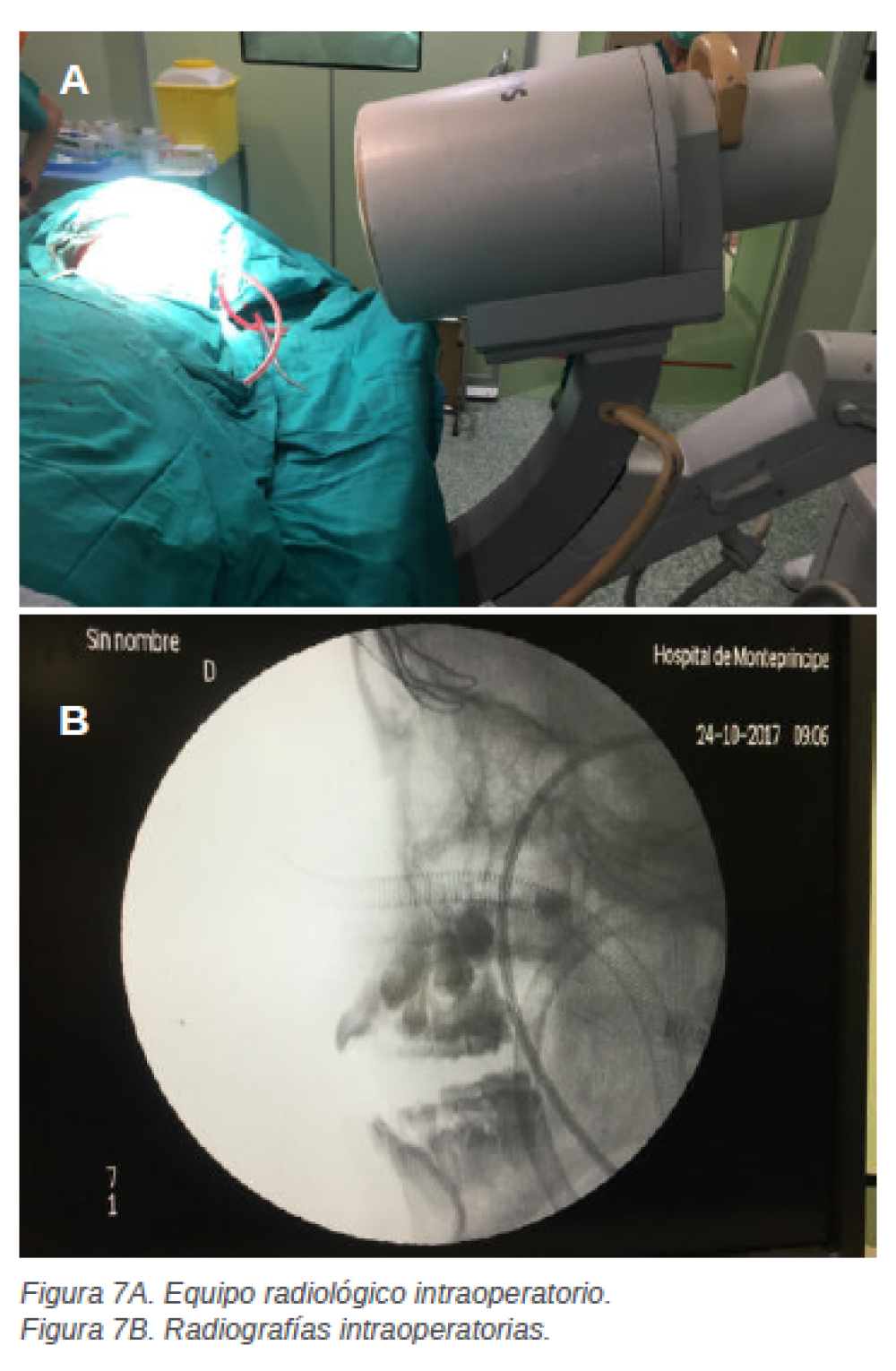
En última instancia para garantizar la exodoncia de todos aquellos dientes incluidos con posibles quistes asociados, se decide llevar a cabo un examen radiográfico intraoperatorio (Figuras 7A y 7B), previo a la reposición y sutura del colgajo con vicryl de 3/ 0. Una semana después de la intervención quirúrgica la paciente acude a revisión y retirada de sutura, todo presenta un aspecto clínico óptimo, la cicatrización transcurre su curso y se decide esperar un mes para realizar radiografías y visitas de control. La paciente es citada a los 2 meses y posteriormente se le realizan visitas de control cada 6 meses.
El SGG es una patología poco frecuente en nuestro medio. De carácter hereditario autosómico dominante su etiología es una mutación en el gen Patched5. Las principales manifestaciones clínicas del SGG son los carcinomas cutáneos de células basales y los quistes maxilares, que aparecen en más del 90% de los pacientes a los 40 años de edad, pero ambos pueden ocurrir antes de los 10 años de edad. Otras manifestaciones menos frecuentes incluyen las calcificaciones de la hoz del cerebro (24%), el meduloblastoma (5%), fibroma cardíaco (3%), paladar hendido (5%) y anomalías oftálmicas (26%). Además de hiperqueratosis palmoplantar y dismorfia facial (macrocefalia, fisura labiopalatina)6-8. El diagnóstico del SGG puede resultar complejo debido a la variabilidad en la expresividad clínica del síndrome y a las diferentes edades de presentación9. El diagnóstico precoz es crucial para los niños afectados y sus familias, teniendo en cuenta el riesgo de desarrollar tumores malignos como meduloblastomas o cánceres de piel de alta agresividad10. Una historia familiar sin antecedentes podría dificultar el reconocimiento clínico temprano de pacientes con SGG. Sin embargo, si el médico o el odontólogo son capaces de detectar los signos clínicos del síndrome puede ser diagnosticado durante la primera infancia7. Es por ello la importancia en la formación de los odontólogos a la hora de adquirir cierta destreza para ser capaces de identificar y derivar a la unidad de cirugía maxilofacial este tipo de patologías, puesto que muchos de estos tumores se diagnostican accidentalmente durante los exámenes radiológicos realizados de manera rutinaria en la consulta odontológica4,10.
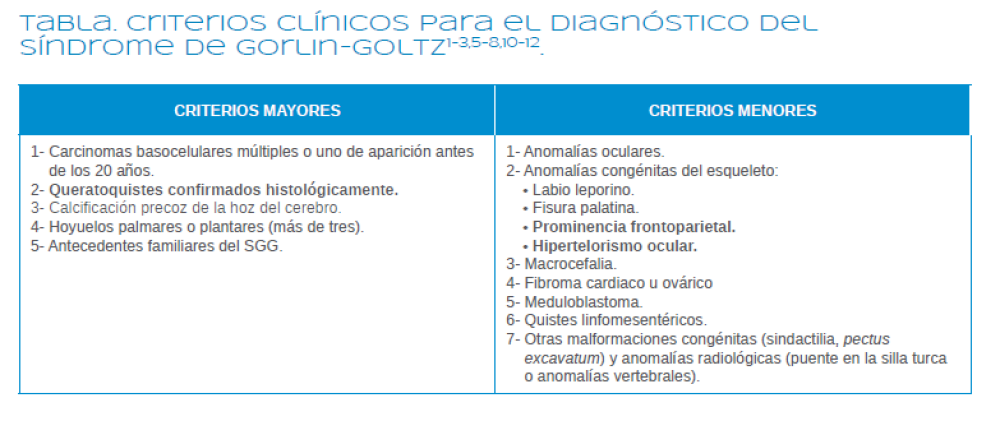
Para poder diagnosticar las lesiones intraorales resultará imprescindible un estudio radiográfico que incluya una radiografía panorámica y un TAC. Los criterios diagnósticos descritos para establecer el diagnóstico del SGG se especifican en la Tabla. Es necesario que el paciente presente 2 de los criterios mayores o bien 1 criterio mayor y 2 menores para poder establecer un diagnóstico de confirmación5-7,11,12.
En la Tabla aparecen señalados aquellos criterios diagnósticos que cumplía la paciente del caso clínico anterior. El signo clínico mas frecuente del SGG es la aparición de queratoquistes odontogénicos, como se ha mencionado previamente. Estos aparecen con una mayor frecuencia en la mandíbula. Un 44% de los mismos aparecen en el ángulo mandibular y en torno a un 18% de estos tumores en las zonas adyacentes a los dientes incisivos y caninos. Con respecto al maxilar, suelen aparecer en la zona de los caninos e incisivos en torno a un 15% de los casos, así como en la zona de los molares, alrededor de un 14% de los casos.
A pesar de que son menos frecuentes en el maxilar, son más agresivos que los que se presentan en mandíbula13. En el caso clínico estudiado previamente se corrobora lo anteriormente mencionado, ya que, en primer lugar, los queratoquistes aparecen en mandíbula, y posteriormente en el maxilar, presentándose en este último, lesiones de mayor envergadura y agresividad, implicando varios dientes. El tratamiento del SGG consiste en tratar cada una de las manifestaciones clínicas que presente el paciente, siendo las lesiones más frecuentes los queratoquistes de los maxilares y los carcinomas basocelulares. El tratamiento de estos últimos implica la eliminación completa de la lesión, siendo la escisión quirúrgica el procedimiento más usado, puesto que se trata de tumores que pueden llegar a ser muy agresivos con infiltración perineural y multifocalidad y sobre todo en casos de recidivas, en ocasiones pueden requerir amplias resecciones que dejan defectos que precisaran reconstrucciones complejas posteriormente6. Cabe destacar, la importancia de evitar la radioterapia en estos pacientes, debido a que esta puede incrementar, tanto el número como la agresividad de los carcinomas basocelulares en las áreas irradiadas, y la incidencia de otros tumores secundarios6,9. Respecto al tratamiento de los queratoquistes de los maxilares implica la extirpación completa de los quistes, y de los dientes incluidos en los mismos, así como el legrado minucioso de las cavidades quísticas remanentes13. Como en el caso de la paciente anterior, en el que gracias al control
y seguimiento realizado, hoy no presenta ningún queratoquiste.
El SGG representa una entidad poco frecuente, pero muy agresiva, por lo que resulta de gran importancia un diagnóstico precoz. La clínica junto a la radiografía panorámica y el TAC resultan indispensables, junto a la histología para determinar su diagnóstico. El tratamiento de elección es la extirpación quirúrgica de los queratoquistes junto al tratamiento del resto de alteraciones que presente el paciente. Cabe destacar la importancia del seguimiento en estos pacientes
en el tiempo.
Ramesh M, Krishnan R, Chalakkal P, Paul
G. Gorlin-Goltz Syndrome: Case report
and literature review. J Oral Maxillofac
Pathol 2015; 19 (2): 267.
Leiva N, Véliz S, González L, Salazar C.
Síndrome Gorlin-Goltz asociado a fisura
labiopalatina bilateral. Rev Cubana De
Estomatol 2015; 52 (2):188-195.
Pruvost-Balland C, Gorry P, Boutet N,
Magnaldo T, Mamelle G, Margulis A,
Kolb B, Duvillard P, Spatz A, Brugières L,
Chompret A, Ávril MF. Clinical and genetic
study in 22 patients with basal cell nevus
syndrome. Ann Dermatol Venereol 2006;
133: 117–23.
Landa C, Gómez F. Síndrome de Gorlin-
Goltz actualización, a propósito de un
caso en el Hospital Infantil de Morelia.
Revista ADM 2017; 74 (2): 94-99.
Visioli F, Martins CA, Heitz C, Rados PV,
Sant’Ana Filho M. Is nevoid basal cell
carcinoma syndrome really so rare? Proposal
for an investigative protocol based
on a case series. J Oral Maxillofac Surg
2010; 68:903-8.
Tandon S, Chauhan Y, Sharma M, Jain M.
Gorlin-Goltz Syndrome: A rare case report
of a 11-year-old child. Int J of Clin Pediatr
Dent 2016; 9 (3): 264-268.
Gilabert R, Infante P, Redondo P, Torres
E, García-Perla García A, Sicilia D. Síndrome
de Gorlin-Goltz: manejo del carcinoma
basocelular facial. Rev Esp Cirug
Oral y Maxilofac 2013; 35 (1): 23-30.
Evans DG, Ladusans EJ, Rimmer S,
Burnell LD, Thakker N, Farndon PA.
Complications of the naevoid basal cell
carcinoma syndrome: results of a population-
based study. J Med Genet 1993; 30
(6): 460-464.
Şereflican B, Tuman B, Şereflican M,
Halıcıoğlu S, Özyalvaçlı G, Bayrak S.
Gorlin-Goltz syndrome. Turk Pediatri Ars
2017; 52 (3): 173-177.
Ramaglia L, Morgese F, Pighetti M, Saviano
R. Odontogenic keratocyst and uterus
bicornis in nevoid basal cell carcinoma
syndrome: Case report and literature review.
Oral Surg Oral Med Oral Pathol Oral
Radiol Endod 2006; 102: 217–9.
Kim HM, Lee CH, Kim SK, Sung TJ. Basal
cell nevus syndrome (Gorlin Syndrome)
confirmed by PTCH mutations and deletions.
Korean J Pediatr 2007; 50: 8.
Kiwilsza M, Sporniak-Tutak K. Gorlin-
Goltz syndrome – a medical condition
requiring a multidisciplinary approach.
Med Sci Monit 2012; 18 (9): RA145-
RA153.
Gorlin RJ. Nevoid basal cell carcinoma
(Gorlin) syndrome. Genet Med 2004; 6:
530–39.

Ochoa Gómez, J
Máster Cirugía Oral e Implantología
CEU San Pablo.
Sánchez Sánchez, R
Profesora Máster Cirugía Oral e
Implantología CEU San Pablo.
Cabezas Mojón, J
Profesora Máster Cirugía Oral e
Implantología CEU San Pablo.
Fernández Domínguez, M
Director del Máster Cirugía Oral e
Implantología CEU San Pablo.