Científica Dental: febrero 2021 (edición exclusiva online)
Revisión bibliográfica
Peña Cardelles JF, Salgado Peralvo AO, Kewalramani Kewalramani N, García Guerrero I, Robles Cantero D, Gómez de Diego R. Patogénesis del dolor en la mucositis oral. Revisión de la literatura. Cient. Dent. 2021; 18; 1; 29-33
Patogénesis del dolor en la mucositis oral. Revisión de la literatura
Introducción: La mucositis oral es una lesión dolorosa que tiene lugar en la mucosa de la cavidad oral, normalmente su etiología se encuentra asociada a tratamientos farmacológicos en pacientes oncológicos. Se presenta como úlceras bien delimitadas cuya sintomatología dolorosa supone en ocasiones la suspensión del tratamiento oncológico o la alimentación por vía parenteral, siendo por tanto un efecto adverso importante, marcando el devenir en este tipo de terapias contra el cáncer.
Objetivo: El objetivo del presente artículo es poner en relieve cómo se produce el dolor en esta patología que acontece en la mucosa de la cavidad oral.
Discusión: La mucositis oral se va a presentar tras una cascada de eventos biológicos que implican diferentes procesos moleculares tras el tratamiento con quimioterapia o radioterapia. El dolor en la mucositis oral puede poseer un componente inflamatorio y también un componente neuropático. En su fisiopatología, el dolor va a estar mediado por diferentes familias de receptores y factores.
Conclusión: La mucositis oral presenta un gran componente doloroso asociado, en el que cobran especial protagonismo en su aparición, las familias de los receptores y factores TRP, ET-1, TNF y ROS, entre otros. El conocimiento de la patogénesis del dolor en esta patología permitirá desarrollar terapéuticas contra el dolor en estudios futuros.
Introduction: Oral mucositis is a painful lesion that occurs in the mucosa of the oral cavity. Its aetiology is usually associated with drug treatments in cancer patients. It presents as well-defined ulcers whose painful symptoms sometimes lead to the suspension of cancer treatment or parenteral nutrition. They therefore represent a significant adverse effect that marks the future in this type of cancer therapy.
Objective: The objective of this article is to highlight how pain occurs in this pathology that takes place in the mucosa of the oral cavity.
Discussion: Oral mucositis will occur following a cascade of biological events involving different molecular processes following treatment with chemotherapy or radiotherapy. Pain in oral mucositis may have an inflammatory component as well as a neuropathic component. In its pathophysiology, pain will be mediated by different families of receptors and factors.
Conclusion: Oral mucositis has a large associated painful component, in which the families of TRP, ET-1, TNF and ROS receptors and factors, among others, play a major role in its appearance. Knowledge of the pathogenesis of the pain in this pathology will allow pain therapies to be developed in future studies.
El dolor representa uno de los mayores desafíos médicos que se acompaña de unas altas consecuencias sociales y económicas a nivel mundial.1 Existen diferentes definiciones del dolor, sin embargo, cabe destacar que la Asociación Internacional para el Estudio del Dolor (IASP) define el dolor como “una experiencia sensorial y emocional desagradable asociada a un daño real o potencial a un tejido o descrito en términos de dicho daño” 2 . Este va a estar presente en la mayoría de las enfermedades que tienen lugar en el ser humano, reflejando o bien el empeoramiento de estas, o una comorbilidad de las mismas, ya que es capaz de producir otras patologías como la depresión, ansiedad o incluso el suicidio3,4 .
Dolor orofacial
El dolor orofacial se define como un dolor que es percibido en la cara y/o cavidad oral. Está causado por enfermedades o trastornos de estructuras regionales, por disfunción del sistema nervioso, o bien el dolor puede estar referido desde un origen o localización lejanos5 . El dolor de esta región se puede clasificar como aquel que tiene lugar en la cavidad oral, directamente relacionado con los dientes y la mucosa oral, así como el dolor neurovascular del que es representativo las migrañas, las cefaleas y la neuralgia del trigémino entre otros múltiples procesos6 .
Este se va a presentar con mayor prevalencia en el sexo femenino, aunque el rango de edad es dispar según la literatura publicada, en los que algunos estudios registran una mayor incidencia en adultos jóvenes y otros en pacientes en torno a los 45-65 años7,8 .
La complejidad del espectro del dolor orofacial se ve agravada por la proximidad de numerosas estructuras anatómicas, que incluyen, ojos, nariz, dientes, lengua, senos paranasales, oídos, musculatura regional y la articulación temporomandibular. Estas estructuras pueden ser el origen del dolor facial que puede referir a áreas cercanas o próximas pero que no están afectadas. Pudiendo estar representados por dolores de cabeza, musculoesqueléticos, neurogénicos, psicógenos y dolores consecuentes de enfermedades sistémicas5,9,10, así como la importancia psicológica de la repercusión en la región facial que aumenta la complejidad del mismo.
Mucositis oral
El tratamiento del cáncer normalmente produce una serie de alteraciones sobre las células normales. La mucosa gastrointestinal y, en especial, la mucosa oral, es muy susceptible a los efectos tóxicos tanto directos como indirectos derivados de la quimioterapia y de la radioterapia. En la cavidad oral este riesgo es el resultado de varios factores, como son la alta tasa de renovación celular de la mucosa, la existencia de una microflora compleja y diversa, y el trauma en los tejidos orales durante la función oral normal11-14 .
La mucositis es la inflamación y ulceración dolorosa de las mucosas que recubren el tracto digestivo, desarrollándose comúnmente de manera secundaria al tratamiento contra el cáncer con radioterapia o quimioterapia. La mucositis puede aparecer a cualquier nivel en el aparato gastrointestinal, aunque es más común en la boca, recibiendo el nombre de mucositis oral (MO)11,13,14 .
La Organización Mundial de la Salud (OMS) llevó a cabo una clasificación de la mucositis, siendo la más leve aquella en la que se observa únicamente un eritema generalizado con molestias inespecíficas, con sensación de quemazón e hipersensibilidad a los alimentos (grado 1). El grado 2 cursa además con úlceras extensas y dolor leve, siendo posible aún la deglución de alimentos. El grado 3 aumenta la severidad de las úlceras y, por tanto, el dolor, existe dificultad en el habla y la posibilidad de ingesta se limita a líquidos. El último grado de esta clasificación, el grado 4, está caracterizado por la presencia de úlceras muy extensas, hiposialia y un dolor muy importante que imposibilita la deglución e ingesta incluso de líquidos15,16 .
El dolor cobra tal protagonismo en esta patología que, desde el campo de la Oncología, se utiliza una clasificación no especializada en el tipo de lesiones orales sino en el nivel del dolor y la incapacidad de ingesta que produce este, se trata de la escala del NCI (National Cancer Institute-USA)17 .
La intensidad del tratamiento antineoplásico condiciona en gran medida la aparición de los efectos adversos sobre la mucosa oral. La aparición de la MO puede llegar a ser del 100% de los casos en pacientes con tratamientos quimioterapéuticos y con radiación en la región de la cabeza y cuello. Los pacientes, además, relatan que se trata del efecto secundario más molesto que experimentan derivado del tratamiento antineoplásico12 .
El objetivo del presente trabajo es describir la fisiopatología del dolor en la MO.
La aparición de la MO se puede resumir principalmente en cinco etapas:
Etapa de iniciación
Esta etapa comienza inmediatamente después de la aplicación de la quimioterapia o la radioterapia. Se produce un daño inicial a las células epiteliales y basales de la mucosa oral, teniendo lugar la liberación de especies reactivas de oxígeno (ROS) que producen un daño en los lípidos de las membranas celulares y en el tejido conectivo de la mucosa oral. Tras esto, tiene lugar una cascada de eventos biológicos que implican diferentes procesos moleculares que se indicarán a continuación18,19 .
Respuesta al daño primario
La activación y liberación de mediadores derivados de la quimioterapia precipita en la lesión de la mucosa oral, dicha lesión se concentra en la región basal del epitelio. Uno de los mediadores más estudiados en el desarrollo de la mucositis es el factor nuclear de liberación Kappa-beta (NFKβ). Este factor regula la expresión de más de 200 genes diferentes, entre estas expresiones, regula las citoquinas proinflamatorias como el factor de necrosis tumoral (TNF), la IL-6 (Interleuquina) y la IL-1β. Estas moléculas aumentan tanto a nivel sanguíneo como a nivel local en el tejido oral y, es importante destacar que, se relacionan con la concentración farmacológica, ya que cuando esta es menor, se produce también una disminución de dichas moléculas y de los síntomas de la MO14,18 .
Se debe destacar que el NFKβ también es capaz de activar la familia B cell lymphoma-2 (BCL-2), que puede inducir de forma directa la apoptosis celular. Por otro lado, las rutas de la esfingomielinasa y ceramida van a estar activadas por las terapias neoplásicas induciendo también apoptosis celulares20 .
Además, se va a producir una alteración del tejido submucoso por el daño a los fibroblastos, que van a inducir metalproteinasas de forma alterada, produciendo cambios en la integridad del epitelio, el tejido conectivo y la submucosa oral18 .
Señalización y amplificación
Como se ha indicado anteriormente, el daño en vías de señalización y de mensajeros celulares, va a traer consigo el daño de las células del epitelio oral. Esto se va a producir de una forma inicial, pero, posteriormente, van a existir vías de retroalimentación positiva, que van a hacer que se produzcan nuevos procesos moleculares, permitiendo que la patología persista en el tiempo. El TNF es capaz de activar procesos proinflamatorios y también puede activar el NFKβ, que además de los procesos ya nombrados, va a producir y acelerar la lesión tisular al activar la vía de las proteínas quinasas activadas por mitógenos (MAPK), que a su vez van a regular el factor de transcripción AP1, que señaliza la transcripción de las metalproteinasas de los fibroblastos18,19 .
Ulceración
La fase de ulceración es la que más sintomatología produce, siendo la fase más dolorosa y caracterizándose por la presencia de úlceras grandes y profundas, recubiertas de una pseudomembrana compuesta por células necróticas y fibrina, siendo una zona susceptible de colonización bacteriana, que va a inducir la proliferación de células inmunes como macrófagos que producen moléculas proinflamatorias18,19 .
Curación
Es la etapa final de la mucositis que consiste en la recuperación de la morfología y salud del epitelio. Normalmente tiene lugar entre 2 o 3 semanas después del inicio de la patología. En esta fase, la ciclooxigenasa-2 (COX-2) va a jugar un papel importante siendo expresada por los fibroblastos y el endotelio vascular, favoreciendo la angiogénesis y la cicatrización de la mucosa14,18 .
El tratamiento de la MO derivado de terapias oncológicas ha tenido un curso complejo, esto podría estar relacionado a que no se ha investigado en profundidad las vías moleculares que causan el dolor en esta patología. Es por ello, que el conocimiento de la fisiopatología del dolor puede ayudar en el desarrollo de tratamientos contra la MO14,18 . (Figura).
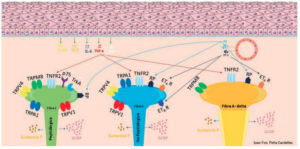
El componente del dolor en la MO puede ser inflamatorio y también neuropático. Los estímulos de la región oral van a estar recogidos por el nervio trigémino (NT), terminando en el núcleo caudal del mismo. Al igual que en otras regiones del organismo, las vías aferentes van a ser fibras A-delta y fibras C, siendo estas últimas peptidérgicas y no peptidérgicas. El dolor nociceptivo en la cavidad oral está modulado por varios receptores diferentes, entre ellos, la familia del receptor de potencial transitorio (TRP), los receptores de la endotelina-1 (ET-1), TNFα y receptores para el factor de crecimiento nervioso (NGF)20 .
Los receptores TRP se expresan en neuronas del ganglio trigeminal, transmitiendo la nocicepción térmica y mecánica de la región orofacial, siendo este último tipo de nocicepción, una de las principales causas de disfunción oral en pacientes con MO21 .
Dentro de la familia TRP los receptores que transmiten la nocicepción mecánica incluyen TRPV1,TRPA1, TRPM821-23 , y TRPV424. La sensibilización del receptor TRP por moléculas de señalización periféricas contribuye aún más al dolor mecánico21,22. La activación de TRPV4 también da como resultado la liberación de endotelina-1 (ET-1)25 , un péptido vasoactivo y nociceptivo.
La ET-1 media la nocicepción en todas las ramas del NT20 . Presenta dos subtipos de receptores, el ETA R y el ETB R, ambos expresados en el ganglio del NT, tanto en el humano como en la rata26,27. Además también se han relacionado con la hiperalgesia térmica orofacial28 . La ET-1 está elevada en la saliva de los pacientes con cáncer oral con dolor29, y el bloqueo de los receptores de endotelina alivia el dolor del cáncer oral en modelos preclínicos30,31 .
El posible vínculo entre la ET-1 y la MO es el factor de transcripción NF-κB. También se ha estudiado en la MO la implicación en la etapa inicial de daño de las células endoteliales por ROS. Las especies de ROS activan el NFκB, estimulando las vías que producen mucositis32 .Se cree que las especies de ROS producen dolor al potenciar la inflamación y aumentar la producción de agentes proalgésicos26 . ET-1 también se activa por NF-κB durante el estrés oxidativo. Estos resultados colectivos sugieren que la ET-1 contribuye a la patogénesis y el dolor de la MO.
Además de la ET-1, otros factores inducidos por NF-κB podrían contribuir a la patogénesis y al dolor de la MO. El TNFα y ciclooxigenasa-2 (COX-2) son dos ejemplos. El TNFα induce dolor al unirse al receptor 2 del factor de necrosis tumoral (TNFR2) en los nociceptores. En pacientes con MO, el ARNm de TNFα en muestras bucales se correlaciona con dolor31,32 . El bloqueo de TNFα reduce la MO en pacientes con cáncer de cabeza y cuello que se someten a quimiorradiación33 . La expresión de COX-2 también aumenta en presencia de MO. Sin embargo, un ensayo clínico controlado realizado no mostró ningún efecto al utilizar un enjuague oral con antagonistas de prostaglandinas sobre el dolor de la MO inducido por quimioterapia33 .
Aparte de los factores discutidos hasta ahora, una clase separada de factores denominados ‘factores neurotróficos’ se secreta en diferentes estados de dolor oral para mediar la nocicepción. Los factores neurotróficos son secretados por neuronas o también, células inflamatorias o células neoplásicas que median el dolor al unirse al receptor p75 de baja afinidad o a la familia de receptores TrK de alta afinidad, que se limitan a las fibras C peptidérgicas. El NGF es posiblemente el factor neurotrófico más estudiado. El NGF se produce en niveles altos por las células neoplásicas orales y median el dolor del cáncer oral. El bloqueo de NGF con anti-NGF produjo un alivio significativo del dolor mecánico, el retorno de la función oral y la reducción de la pérdida de peso en un modelo de ratón con cáncer oral34 .
El otro componente del dolor que puede estar presente en la mucositis es el dolor neuropático, causado por la sensibilización neuronal por agentes quimioterapéuticos y mediadores inflamatorios como el glutamato, la sustancia P, el GCRP y el NGF que son secretados por las fibras neuronales A-delta y C del trigémino en el núcleo caudal y la periferia. Las fibras peptidérgicas C producen el componente de inflamación neurogénica de la compleja respuesta al dolor que se observa con la MO. La liberación de glutamato contribuye fuertemente a la inflamación35,36 . Otras citoquinas proinflamatorias como el TNFα, IL-2, IL-6, IL-1β en el sitio de la lesión de la mucosa dan como resultado la sensibilización neuronal. Dados estos hallazgos, se han explorado los efectos de las citoquinas antiinflamatorias en la reducción de la patogénesis y el dolor de la mucositis. Aunque se han mostrado prometedores en múltiples modelos preclínicos, estos resultados no han sido respaldados por estudios clínicos33-35 .
La MO presenta un gran componente doloroso asociado, en el que cobran especial protagonismo en su aparición, las familias de los receptores y factores TRP, ET-1, TNF y ROS, entre otros. El conocimiento de la patogénesis del dolor en esta patología permitirá desarrollar terapéuticas contra el dolor en estudios futuros.
Henschke N, Kamper SJ, Maher CG. The epidemiology and economic consequences of pain. Mayo Clin Proc 2015; 90(1): 139-47.
Ibarra E. Una nueva definición de “dolor”: un imperativo de nuestros días. Rev Soc Esp Dolor 2006; 13(2): 65-72.
Braden JB, Sullivan MD. Suicidal thoughts and behavior among adults with self-reported pain conditions in the national comorbidity survey replication. J Pain 2008; 9: 1106–15.
Soriano JB, Rojas-Rueda D, Alonso J y cols., The burden of disease in Spain: results from the global burden of disease 2016. Med Clin (Barc) 2018; 151: 171-90.
Heir GM, Khan J, Mannheimer JS y cols., Relationship of dysfunction of the temporomandibular joint, headache and primary cervicalgia (Relação entre disfunções temporomandibulares, cefaleias primarias e cervicalgias); Chpt 46 in Orofacial Pain Diagnosis and Treatment (Dores Orofaciais Diagnstico e Tratamento); Eds. De Siqueira JDT, Teixeira MJ, Artes Médicas, São Paulo, Brazil, 2012.
Bender SD. Orofacial pain and headache: a review and look at the commonalities. Curr Pain Headache Rep 2014; 18: 400.
Riley JL 3rd, Gilbert GH. Orofacial pain symptoms: an interaction between age and sex. Pain 2001; 90: 245-56.
Macfarlane TV, Blinkhorn AS, Davies RM, y cols., Oro-facial pain in the community: prevalence and associated impact. Community Dent Oral Epidemiol 2002; 30: 52-60.
Okeson JP. Orofacial pain: guidelines for classification, assessment, diagnosis, and management. The American Academy of Orofacial Pain. 3rd. Chicago: Quintessence Publishing Co, 1996.
De Leeuw R, Klasser GD. Orofacial pain: Guidelines for assessment, diagnosis, and management. Fifthth ed Chicago: Quintessence Publishing Co, Inc; 2013: 312.
Keefe DM, Schubert MM, Elting LS y cols., Mucositis study section of the multinational association of supportive care in cancer and the international society for oral oncology. Updated clinical practice guidelines for the prevention and treatment of mucositis. Cancer 2007; 109: 820-831.
Sonis ST. Oral mucositis. Anticancer Drugs 2011; 22: 607-12.
Sonis ST. The pathobiology of mucositis. Nat Rev Cancer 2004; 4: 277-84.
Sonis ST. Pathobiology of oral mucositis: novel insights and opportunities. J Support Oncol 2007; 5: 3-11.
Sonis ST. A Biological approach to mucositis. J Support Oncol 2004; 2: 21-32.
López-Castaño F, Oñate-Sánchez RE, Roldán-Chicano R y cols., Measurement of secondary mucositis to oncohematologic treatment by means or different scale. Med Oral Pathol Oral Circ Bucal 2005; 10: 412-420
World Health Organization. Handbook for reporting results of cancer treatment. World Health Organization: 1979: 15-22.
Cancer therapy evaluation program: Common toxicity criteria version 3.0. DCTD, NCI, NHI, DHHS; 2006.
Kusiak A, AlicjaJereczek-Fossa B, Cichońska D, y cols., Oncological-therapy related oral Mucositis as an interdisciplinary problem-literature review. Int J Environ Res Public Health 2020; 1: 2464
Villa A, Sonis ST. Mucositis: pathobiology and management. Curr Opin Oncol 2015; 27: 159-64.
Viet CT, Corby PM, Akinwande A, y cols., Review of preclinical studies on treatment of mucositis and associated pain. J Dent Res 2014; 93: 868-75.
Alessandri-Haber N, Dina OA, Chen X y cols., TRPC1 and TRPC6 channels cooperate with TRPV4 to mediate mechanical hyperalgesia and nociceptor sensitization. J Neurosci 2009; 29: 6217-28.
Nilius B, Owsianik G, Voets T y cols., Transient receptor potential cation channels in disease. Physiol Rev 2007; 87: 165-217.
Colburn RW, Lubin ML, Stone DJ Jr y cols., Attenuated cold sensitivity in TRPM8 null mice. Neuron 2007; 54: 379-86.
Basbaum AI, Bautista DM, Scherrer G, y cols., Cellular and molecular mechanisms of pain. Cell 2009; 139: 267-84.
Alessandri-Haber N, Dina OA, Chen X y cols., UVB radiation generates sunburn pain and affects skin by activating epidermal TRPV4 ion channels and triggering endothelin-1 signaling. Proc Natl Acad Sci U S A. 2013; 110: E3225-34.
Chichorro JG, Fiuza CR, Bressan E y cols., Endothelins as pronociceptive mediators of the rat trigeminal system: role of ETA and ETB receptors. Brain Res 2010; 1345: 73-83.
Uddman R, Tajti J, Cardell LO y cols., Endothelin ETA and ETB receptor expression in the human trigeminal ganglion. Neuro Endocrinol Lett 2006; 27: 345-9.
Yamamoto T, Ono K, Hitomi S y cols., Endothelin receptor-mediated responses in trigeminal ganglion neurons. J Dent Res 2013; 92: 335-9.
Chichorro JG, Zampronio AR, Cabrini DA y cols. Mechanisms operated by endothelin ETA and ETB receptors in the trigeminal ganglion contribute to orofacial thermal hyperalgesia induced by infraorbital nerve constriction in rats. Neuropeptides 2009; 43: 133-42.
Pickering V, Jordan RC, Schmidt BL. Elevated salivary endothelin levels in oral cancer patients-a pilot study. Oral Oncol 2007; 43: 37-41.
Quang PN, Schmidt BL. Endothelin-A receptor antagonism attenuates carcinoma-induced pain through opioids in mice. J Pain 2010; 11: 663-71.
Quang PN, Schmidt BL. Peripheral endothelin B receptor agonist-induced antinociception involves endogenous opioids in mice. Pain 2010; 149: 254-62.
Ye Y, Dang D, Zhang J y cols., Nerve growth factor links oral cancer progression, pain, and cachexia. Mol Cancer Ther 2011; 10: 1667-76.
Haas HS, Linecker A, Pfragner R y cols., Peripheral glutamate signaling in head and neck areas. Head Neck 2010; 32: 1554-72.

Peña Cardelles, Juan Francisco
Profesor del Máster en Cirugía Bucal e Implantología de la Universidad Rey Juan Carlos. Máster en Aspectos Clínicos y Básicos del dolor, URJC, Especialista en Medicina Oral, UCM.
Salgado Peralvo, Ángel Orión
Máster en Odontología Familiar y Comunitaria, Universidad de Sevilla. Máster en Implantología Oral, Universidad de Sevilla.
Kewalramani Kewalramani, Naresh
Profesor del Máster en Implantología, regeneración tisular y rehabilitación implantosoportada, Universidad Rey Juan Carlos.
García Guerrero, Iván
Profesor del Máster en Cirugía Bucal e Implantología, Universidad Rey Juan Carlos.
Robles Cantero, Daniel
Profesor del Máster en Cirugía Bucal e Implantología, Universidad Rey Juan Carlos
Gómez de Diego, Rafael
Profesor del Máster en Cirugía Bucal e Implantología, Universidad Rey Juan Carlos.

