Revisión bibliográfica
Serrano Zamora R, Ochoa-López G, Iglesias Velázquez O, Sánchez Labrador L. González Fernández-Tresguerres F, Meniz García C. Evaluación de la cantidad de hueso neoformado al emplear materiales de relleno en elevación de seno maxilar con abordaje lateral. Cient. Dent. 2021; 18; 3; 183-192
Evaluación de la cantidad de hueso neoformado al emplear materiales de relleno en elevación de seno maxilar con abordaje lateral
Introducción. La cirugía de elevación de seno es un procedimiento realizado en cirugía bucal para conseguir aumentar el volumen óseo en sectores posteriores de maxilares atróficos y así poder rehabilitar la zona con implantes dentales. El objetivo de esta revisión es conocer la cantidad de hueso neoformado, en función del tipo de biomaterial empleado, en la técnica de elevación de seno mediante técnica abierta.
Material y métodos. Para cumplir con dicho objetivo se ha llevado a cabo una búsqueda bibliográfica en las principales bases de datos (PubMed/MEDLINE, Cochrane Library, Scopus y Web of Science).
Resultados. 18 artículos han sido incluidos para su comparación y discusión en esta revisión. En todos ellos, el estudio histomorfométrico de los materiales de injerto en la elevación de seno fue llevado a cabo, permitiendo conocer la cantidad (%) de hueso nuevo formado con cada biomaterial. Los materiales de injerto empleados son diversos, encontrando hueso autólogo, aloinjerto, xenoinjerto y materiales sintéticos; combinación de algunos de estos materiales entre sí e incluso con concentrados plaquetarios, proteína morfogenética ósea y células madre mesenquimales.
Conclusiones. El empleo de hueso autólogo como biomaterial en la cirugía de elevación de seno maxilar mediante técnica abierta, obtiene el mayor porcentaje de hueso nuevo formado. Sin embargo, los resultados obtenidos son también satisfactorios empleando materiales de injerto de diferente naturaleza.
Introduction. Sinus augmentation is a common procedure performed in dental practice to increase bone volume in atrophic posterior maxilla in order to rehabilitate this area with dental implants. The aim of this review is to know the amount of new bone formation in sinus lift surgery by open technique depending of the biomaterial used.
Material and methods. A comprehensive literature search was conducted in the main databases (PubMed/MEDLINE, Cochrane Library, Scopus and Web of Science).
Results. The search yielded 18 results that met the inclusion criteria. In all of them, the histomorphometric study of the materials grafted was studied, allowing to know the amount of new bone formed with each biomaterial. The graft materials used are diverse, finding autologous bone, allograft, xenograft and alloplastic materials. Furthermore, it is used the combination of some of these materials with each other and even with platelet concentrates, bone morphogenetic proteins and mesenchymal stem cells.
Conclusions. The use of autologous bone as biomaterial in maxillary sinus lift surgery by open technique obtains the highest percentage of new bone formed. However, the results obtained in sinus lift surgery are satisfactory using graft materials of different nature.
El seno maxilar es una estructura anatómica situada bilateralmente en el hueso maxilar, siendo el seno paranasal de mayor tamaño. Esta cavidad neumática de aspecto piramidal se encuentra en íntimo contacto con las fosas nasales, a través de un ostium de drenaje localizado en el meato medio. Alcanza su tamaño adulto una vez completada la dentición permanente; no obstante, ciertas situaciones como la pérdida dentaria, pueden provocar un aumento del tamaño del mismo. Se encuentra revestido por un epitelio cilíndrico ciliado pseudoestratificado con células formadoras de moco denominado membrana de Schneider. Entre las funciones del seno maxilar destaca su función de limpieza. Respecto a sus límites anatómicos, cabe destacar su pared inferior ya que el suelo del seno se corresponde con los procesos alveolares y palatinos del maxilar y por ello guarda estrecha relación con los denominados dientes antrales: premolares y molares superiores principalmente1-3.
El empleo de implantes dentales para la rehabilitación de espacios edéntulos es una de las opciones terapéuticas más empleadas en la actualidad. Sin embargo, entre los factores que comprometen la colocación ideal de los implantes, se encuentra la falta de un adecuado volumen óseo. La rehabilitación de la región posterior maxilar supone a menudo un reto terapéutico, debido a la reabsorción del proceso alveolar o la neumatización del seno maxilar como consecuencia de la pérdida o extracción dental llevada a cabo en esa zona.4,5 Algunos de estos casos de atrofia maxilar severa en los que únicamente una fina capa de hueso separa el seno maxilar de la cavidad oral, dificultando o imposibilitando la colocación de implantes, se pueden solucionar con técnicas de aumento óseo, destacando entre ellas la elevación del seno maxilar.6
Existen principalmente dos técnicas de elevación sinusal, las cuales han sido ampliamente descritas y comparadas en la literatura y de las que han ido surgiendo variaciones y modificaciones en el transcurso de los años. Por un lado, se encuentra la técnica abierta, también denominada de ventana lateral o traumática, descrita por Tatum en 1976 y posteriormente publicada por Boyne y James en 1980. En esta técnica, el abordaje se hace a través de una ventana lateral en la cara anteroexterna del seno mediante la realización de un colgajo mucoperióstico y de una osteotomía lateral crestal, despegando posteriormente la membrana sinusal. Es la técnica de elección en casos con altura ósea inferior a 4 mm2,7 Como alternativa a la anterior, se desarrolló posteriormente la técnica cerrada o atraumática, propuesta por Tatum en 1986 y modificada por Summers en 1994. Esta técnica se considera más conservadora que la técnica abierta y se caracteriza por ser un procedimiento transalveolar con la consecuente fractura del suelo del seno maxilar y la elevación de la membrana mediante la utilización de osteotomos. Esta técnica es más favorable cuando hay al menos 5 mm de altura2,8,9.
En ambas técnicas, pueden emplearse o no materiales de relleno y la colocación de los implantes se realizará de forma inmediata o diferida en función de la cantidad de tejido óseo disponible y la estabilidad conseguida. Entre los diferentes materiales de injerto en cirugía de elevación de seno se encuentran: autoinjertos, aloinjerto, xenoinjerto, aloplásticos, etc. El desarrollo de estos materiales ha ido ligado a la necesidad de conseguir ciertas propiedades que se consideran ideales para este tipo de sustitutos óseos como son osteoconducción, osteogénesis, osteoinducción, biorreabsorción y estabilidad volumétrica10.
El objetivo de esta revisión de la literatura es conocer la cantidad de hueso neoformado, en función del tipo de biomaterial empleado, en la técnica de elevación de seno mediante técnica abierta.
Se realizó una búsqueda de la literatura científica publicada en las bases de datos electrónicas PubMed/MEDLINE, Cochrane Library, Scopus y Web of Science. Además, se llevó a cabo una búsqueda manual a través de las referencias bibliográficas de los artículos seleccionados.
La estrategia de búsqueda se realizó combinando los siguientes términos con operadores booleanos: (maxillary sinus) OR (sinus) AND (augmentation) OR (grafting) OR (lift) OR (floor augmentation) OR (floor elevation) AND (material) OR (biomaterial).
Criterios de elegibilidad
Los criterios de inclusión establecidos fueron: (a) estudios in vivo, ensayos clínicos y estudios de cohortes (b) publicados en los últimos diez años, (c) redactados en inglés, (d) que analicen mediante histomorfometría la cantidad de hueso nuevo formado tras el empleo de materiales de relleno en elevación de seno empleando técnica abierta, (e) pudiendo emplearse como material de injerto cualquiera de los citados a continuación: autoinjerto, aloinjerto, xenoinjerto, material aloplástico, injertos compuestos (hueso autógeno y aloinjerto; hueso autógeno y xenoinjerto; injerto de hueso autógeno y aloplástico; aloinjerto y xenoinjerto), cualquier injerto óseo asociado con factores de crecimiento derivado de plaquetas, cualquier injerto asociado con proteína morfogenética ósea recombinante y cualquier injerto asociado con células madre mesenquimales (MSC).
Como criterios de exclusión se establecen estudios in vitro, en animales, reporte de casos, estudios transversales, aquellos estudios donde solo se emplee el propio coágulo sanguíneo y todos aquellos estudios que no cumpliesen los criterios de inclusión.
Selección de los estudios
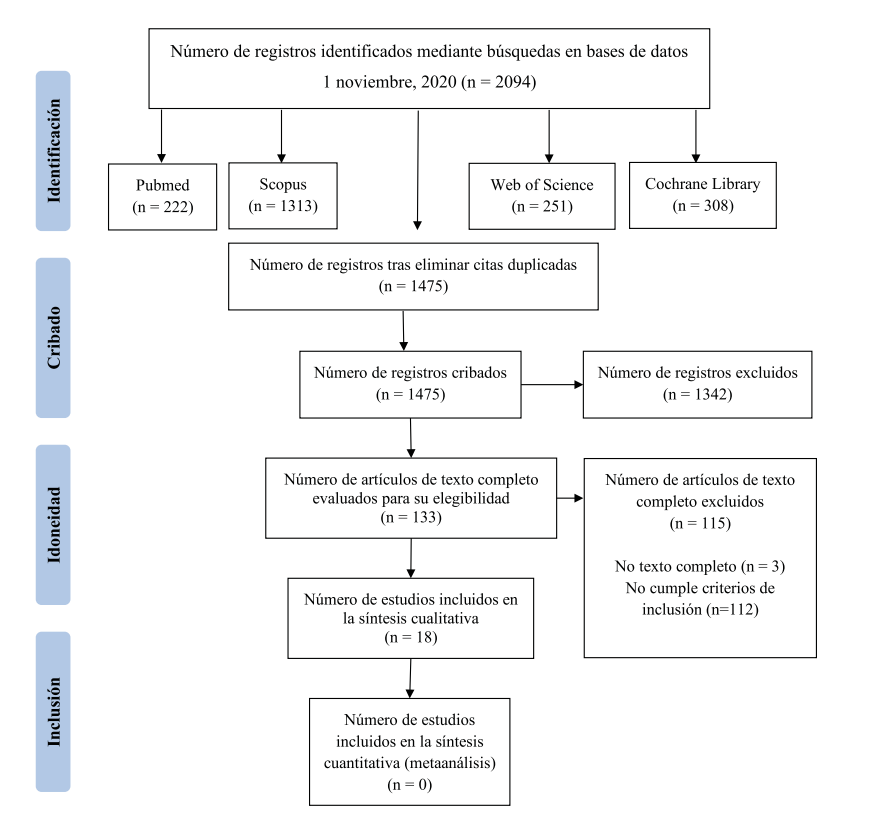
En la Figura puede observarse el diagrama de flujo del proceso de selección de los estudios. Como resultado de la estrategia de búsqueda, se recopilaron inicialmente un total de 2.094 referencias, quedando 1.475 tras eliminar citas duplicadas. A continuación, dos revisores independientes (RSZ y GOL) llevaron a cabo la revisión de estos artículos por “título y abstract”, excluyendo 1.342 artículos por abordar cuestiones no relacionadas con el objetivo de esta revisión. Los 133 artículos potenciales fueron nuevamente evaluados, en esta ocasión a texto completo. De ellos, 115 fueron excluídos (3 no disponibles a texto completo; 112 por no cumplir los criterios de inclusión). Finalmente, 18 artículos se incluyeron en esta revisión10-27.
Características de los estudios
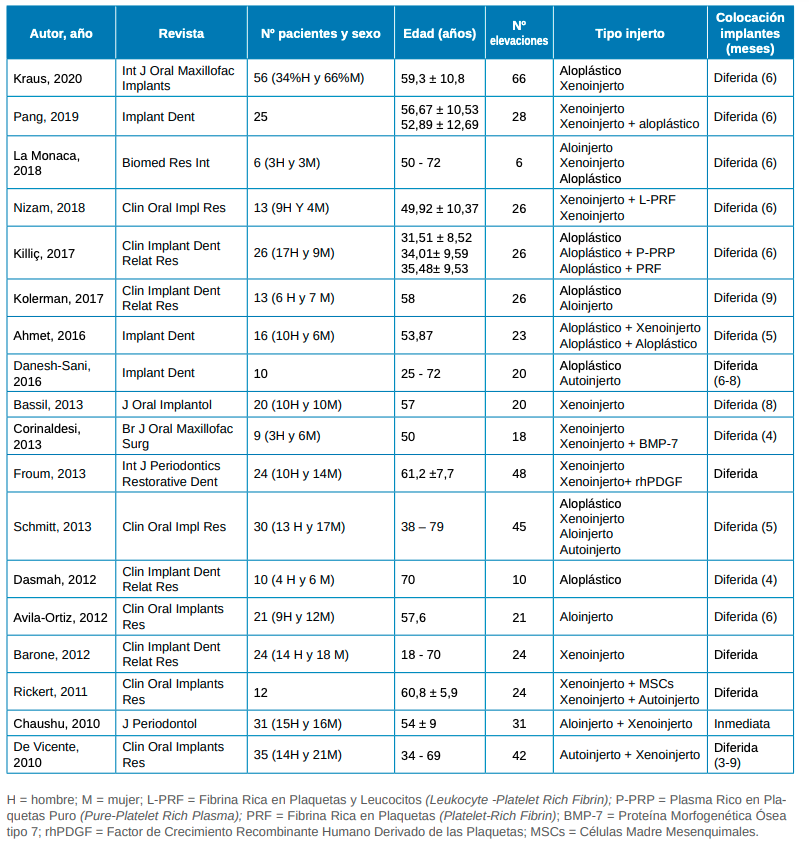
Los artículos seleccionados fueron publicados entre los años 2010 y 2020. En total, se registran 549 elevaciones de seno mediante técnica de acceso lateral empleando material de injerto en un total de 381 pacientes. En todos los estudios, a excepción del estudio de Bassil y cols., 2013, se colocó membrana reabsorbible cubriendo la ventana lateral realizada después de cada una de las elevaciones. La colocación de los implantes dentales se realizó en 17 de los estudios de forma diferida; mientras que la colocación de los mismos de forma inmediata únicamente se llevó a cabo en uno de los estudios (Tabla 1).

Entre los estudios incluidos, se emplean xenoinjertos en 9 de ellos10-13,18-21,24; aloinjertos en 412,15,21,23; aloplásticos en 710,12,13,15,17,21,22; autoinjertos en 21721; o injertos mixtos en 911,13,14,16,19-21,26,27 (Tabla 1).
Por otro lado, respecto al número de grupos de estudio, en 6 de los artículos incluidos se analiza un único grupo o cohorte18, 22-24,26,27; mientras que en los 12 artículos restantes aparecen diferentes grupos de estudio comparando diferentes materiales de relleno en cada uno de ellos10-17,19-21,25 (Tabla 1).
Porcentaje de hueso neoformado
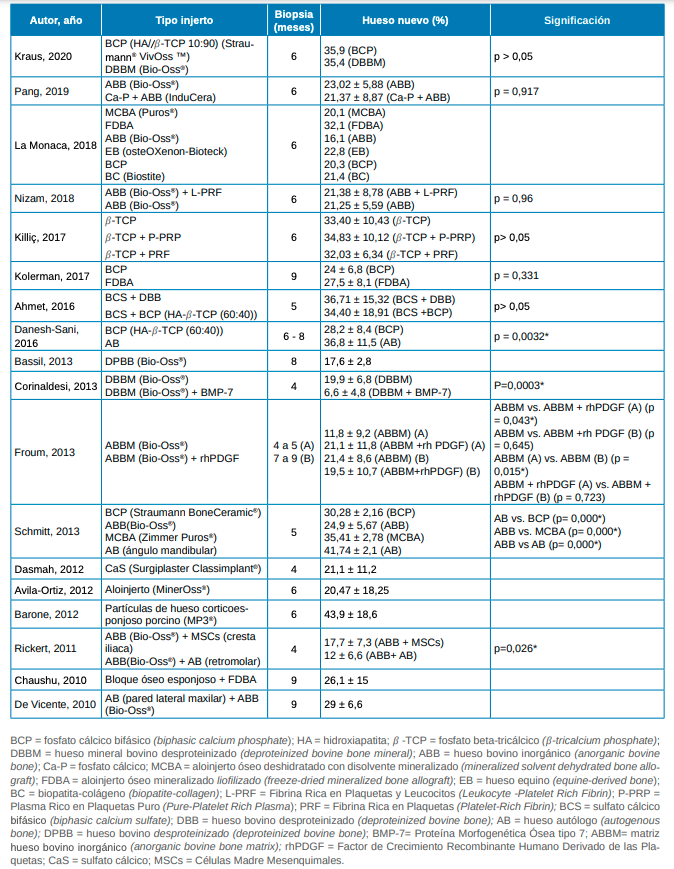
La variable principal estudiada en esta revisión es el porcentaje de hueso nuevo (NH) formado tras la colocación de injertos en la cirugía de elevación de seno maxilar con técnica abierta. Estos valores se obtienen con la toma de biopsia de la zona injertada, realizada entre los 4 a 9 meses en los estudios incluidos. Mediante un estudio histomorfométrico de la muestra se obtienen porcentajes de volumen del hueso nuevo formado, además de otros datos de interés como la cantidad de injerto óseo restante y el tejido blando, fibroso o conectivo.
El xenoinjerto es un material empleado en numerosos estudios. En el estudio de Bassil y cols., 2013, se emplea hueso bovino desproteinizado (DPBB) (Bio-Oss®) obteniendo un porcentaje de NH de 17,6% ± 2,8% a los 8 meses.18 En el estudio de Barone y cols., 2012, se emplea hueso particulado corticoesponjoso de origen porcino (MP3®), obteniéndose un 43,9 % de NH a los 6 meses24 (Tabla 2).
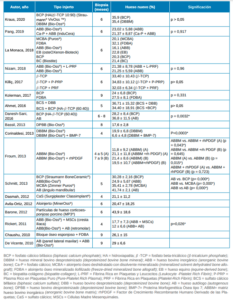
También se han encontrado estudios donde el material de relleno es de tipo aloplástico o sintético, como el estudio de Dasmah y cols., 2012 en donde se empleó sulfato cálcico (CaS) (Surgiplaster Classimplant®) obteniendo una neoformación ósea a los 4 meses de 21,1 ± 11,2%22 (Tabla 2).
Además de xenoinjerto y materiales aloplásticos, se han encontrado estudios donde se emplean aloinjertos. Avila-Ortiz y cols. emplearon un aloinjerto mineral (MinerOss®) como material de relleno en las elevaciones sinusales realizadas obteniendo a los 6 meses un 20,47 ± 18,25% de hueso nuevo formado.23 En el estudio de Chausu y cols., 2010 se utilizó bloque óseo esponjoso de origen alogénico junto con aloinjerto óseo mineralizado liofilizado (FDBA), obteniendo una formación ósea del 26,1 ± 15% a los 9 meses26 (Tabla 2).
Respecto al empleo de hueso autólogo como material, en el estudio de Vicente y cols., 2010 se empleó tejido óseo extraído de la pared lateral maxilar mezclado con Bio-Oss® obteniendo un total de 29 ± 6,6% de hueso nuevo formado a los 9 meses27 (Tabla 2).
La eficacia entre unos materiales de relleno y otros ha sido analizada en varios de los estudios incluidos en esta revisión. En el estudio de Kraus y cols., 2020 se compara el empleo de un xenoinjerto como es el mineral óseo bovino desproteinizado (DBBM) (Bio-Oss®) versus un material aloplástico (Straumann®VivOss™) que consiste en fosfato cálcico bifásico (BCP), formado por hidroxiapatita (HA) + fosfato beta-tricálcico (β-TCP), en donde la cantidad de NH fue de 35,9% y 35,9% respectivamente a los 6 meses sin diferencias estadísticamente significativas (p>0.05)10. En el estudio de Pang y cols., 2019, también se compara el empleo de Bio-Oss® y hueso bovino inorgánico (ABB) revestido por fosfato cálcico (Ca-P) (InduCera), obteniendo a los 6 meses un 23,02 ± 5.88% y 21,37 ± 8,87% respectivamente de hueso nuevo sin diferencias estadísticamente significativas (p=0,917)11 (Tabla 2).
Kolerman y cols. compararon el empleo de materiales aloplásticos como el BCP con el FDBA. La cantidad de hueso nuevo formado a los 9 meses en el caso del FDBA fue del 27,5 ± 6,8%, siendo superior a la cantidad obtenida al emplear BCP (24 ± 6,8%); sin embargo, no se encontraron diferencias estadísticamente significativas entre ambos (p=0,331).15 El BCP también se empleó en el estudio de Danesh-Sani y cols., 2016 siendo comparado su empleo con hueso autólogo. El NH formado a los 6-8 meses fue de 28,8 ± 8,4% en aquellos casos en los que se empleó BCP frente al 36,8 ± 11.5% obtenido al utilizar hueso autólogo, obteniendo una diferencia estadísticamente significativa entre ambos materiales (p=0,0032)17 (Tabla 2).
Otro material de injerto aloplástico como es el sulfato cálcico bifásico (BCS) se ha estudiado en combinación con hueso bovino desproteinizado (DBB) y con BCP. En el estudio de Ahmet y cols., 2016 a los 5 meses, la combinación de material aloplástico y xenoinjerto (BCS + ABB) logró una formación de hueso nuevo del 36,71 ± 15,32% frente al 34,40 ± 18,91 % obtenido al emplear dos materiales aloplásticos (BCS + BCP). Sin embargo, no se encontraron diferencias estadísticamente significativas entre ambos grupos (p>0,05)16 (Tabla 2).
La Monaca y cols., analizaron la formación de hueso nuevo comparando aloinjerto, xenoinjerto y materiales de origen aloplástico: aloinjerto óseo deshidratado con disolvente mineralizado (MCBA), aloinjerto óseo mineralizado liofilizado (FDBA), hueso bovino inorgánico (ABB), hueso equino (EB), fosfato cálcico bifásico (BCP) y biopatita-colágeno (BC), obteniendo una formación de hueso nuevo a los 6 meses de 20,1%, 32,1%, 16,1%, 22,8%, 20,3% y 21,4% respectivamente12 (Tabla 2).
La comparación entre hueso autógeno, aloinjerto, xenoinjerto y materiales aloplásticos se puede observar en el estudio de Schmitt y cols., 2013 donde se empleó BCP (Straumann BoneCeramic®), ABB (Bio-Oss®), MCBA (Zimmer Puros®) y hueso autólogo (AB) del ángulo mandibular. El nuevo hueso formado a los 5 meses fue del 30,28 ± 2,16 %; 24,9 ± 5,67; 35,41 ± 2,78; 41,74 ± 2,1% respectivamente, encontrándose diferencias estadísticamente significativas entre AB vs. BCP; ABB vs. MCBA; ABB vs. AB (p=0.000); (p=0.000); (p=0.000)21 (Tabla 2).
En la cirugía de elevación de seno, también se han empleado concentrados plaquetarios junto con otros materiales de relleno tradicionales. Killiç y cols., compararon el empleo β-TCP sólo y en combinación con plasma rico en plaquetas puro (P-PRP) o fibrina rica en plaquetas (PRF), obteniendo a los 6 meses una formación de hueso nuevo del 33,40 ± 10,43%, 34,83 ±10,12% y 32,03 ± 6,34%, concluyendo que la adición de P-PRP o PRF a β-TCP no aumentaba la formación de hueso nuevo (p>0,05).14 Los concentrados plaquetarios también se han estudiado en combinación con xenoinjertos. En el estudio de Nizam y cols,. se comparó el empleo de Bio-Oss® solo y en combinación con fibrina rica en plaquetas y leucocitos (L-PRF), obteniendo 21,25 ± 5,59% y 21,38 ± 8,78 respectivamente de hueso nuevo a los 6 meses, sin diferencias significativas (p=0,96)13 (Tabla 2).
Además de los concentrados plaquetarios, también se han combinado los materiales de relleno con otros factores de crecimiento como Proteína Morfogenética Ósea tipo 7 (BMP-7) como en el estudio de Corinaldesi y cols., 2013 donde se comparó la cantidad de hueso nuevo formado al emplear Bio-Oss® (19,9 ± 6,8%) y Bio-Oss® + BMP-7 (6,6 ± 4,8%) obteniendo diferencias estadísticamente significativas (p=0.0003) a los 4 meses19 (Tabla 2).
Froum y cols., compararon el nuevo hueso formado empleando Bio-Oss® solo y en combinación con Factor de Crecimiento Recombinante Humano Derivado de las Plaquetas (rhPDGF) en dos tiempos diferentes (a los 4-5 meses y a los 7-9 meses). Se encontraron diferencias estadísticamente significativas en la cantidad de NH a los 4-5 meses al emplear Bio-Oss® (11,8 ± 9,2%) y Bio-Oss® combinado con rhPDGF (21,1 ± 11,8 %) (p=0,043). Sin embargo, la diferencia entre ambos grupos no fue estadísticamente significativa a los 7-9 meses (p=0,645)20 (Tabla 2).
Rickert y cols., combinaron el uso de Bio-Oss® con Células Madre Mesenquimales (MSCs) obtenidas de la cresta iliaca y lo compararon con el uso de Bio-Oss® y hueso autólogo obtenido del área retromolar. A los 4 meses, vieron que Bio-Oss® y MSCs inducían mayor formación de hueso (17,7%) que el otro grupo (12%) con diferencia significativa (p=0,026)25 (Tabla 2).
Idealmente, los materiales de injerto óseo empleados deberían cumplir los principios biológicos de osteogénesis, osteoinducción y osteoconducción para asegurar una correcta adaptación del tejido injertado a la zona receptora y favorecer la posterior formación de hueso. Se define la osteoconducción como la capacidad de un material para permitir el crecimiento de hueso sobre su superficie, actuando como un andamiaje. Por otro lado, el concepto de osteoinducción hace alusión a la capacidad del material para reclutar e inducir la diferenciación de células inmaduras durante el proceso de regeneración ósea. Por último, la osteogénesis es la capacidad de producir hueso nuevo y está determinado principalmente por la supervivencia de las células trasplantadas, especialmente preosteoblastos y osteoblastos. Sin embargo, no todos los materiales de injerto óseo cumplen todas estas características, a excepción del hueso autólogo28-30.
Otro mecanismo destacable de los injertos óseos es la biorreabsorción, cualidad por la cual algunos injertos son reabsorbidos para desaparecer total o parcialmente en función del tiempo y permitir así su sustitución por tejidos propios del individuo, en un proceso denominado creeping substitution.
Un método de evaluación en la regeneración de elevación de seno maxilar es el análisis histomorfométrico tomando biopsias óseas, que permiten determinar el porcentaje de hueso nuevo formado, partículas de injerto residual y componentes de tejido conectivo de la biopsia realizada en el lugar donde se colocó el injerto durante el período de cicatrización31, 32. Estos parámetros son clínicamente muy importantes para evaluar el éxito de este procedimiento quirúrgico: un mayor porcentaje de hueso nuevo y menor injerto residual indican una integración exitosa del injerto óseo, que finalmente mejora la supervivencia del implante.33
El injerto autógeno o hueso autólogo, presenta las propiedades ideales de osteogénesis, osteoinducción y osteoconducción, convirtiéndose en el gold standard en las cirugías de regeneración ósea. Pueden contener hueso cortical, esponjoso, cortico-esponjoso y presentarse en bloque. Los injertos pueden obtenerse de fuentes intraorales o extraorales. Sin embargo, el aumento de la morbilidad, la disponibilidad limitada y la alta tasa de reabsorción del injerto (hasta 40%) hacen que sean menos deseables. La supervivencia de los implantes colocados en injertos de bloque es significativamente menor que los implantes colocados en injerto particulado34, 35.
Los injertos óseos alogénicos, o aloinjertos, se obtienen de individuos de la misma especie que el receptor del injerto. Los bancos de hueso permiten disponer de una cantidad ilimitada de hueso y sin la morbilidad de su extracción. Gracias al screening previo y a los test serológicos llevados a cabo por los bancos de hueso, el riesgo de transmisión de enfermedades es inexistente. Son materiales osteoconductores que también actúan como armazones de mantenimiento del espacio para la regeneración del hueso. Su capacidad osteoinductora puede incrementarse mediante la eliminación de la porción mineralizada del injerto para crear un material con una mayor concentración de proteínas morfogenéticas óseas (BMPs) y otras proteínas específicas del hueso34,35.
Los xenoinjertos proceden de especies distintas al receptor, siendo de origen animal o mineral derivados de coral o algas y actúan como injertos osteoconductores semipermanentes o de reabsorción lenta. Estos materiales mantienen bien el espacio, con una alta radiopacidad que ayuda a identificar el material en el seno. Presentan una fácil disponibilidad y están íntegramente libres de peligro de transmisión de enfermedades, siempre y cuando se cumplan los protocolos de procesamiento de esterilidad. Los xenoinjertos más empleados en la práctica diaria son, los derivados de hueso bovino, porcino y equino.34,35 Se ha descrito la suplementación de células derivadas de hueso autógeno a un material de injerto libre de células como puede ser el hueso mineral bovino. La razón para agregar una pequeña cantidad de hueso autógeno es la de agregar osteoblastos, combinados con PRP, con el propósito de utilizar la capacidad osteoinductora del hueso36.
Los materiales de injerto aloplástico son materiales sintéticos como polímeros, biocerámicas y cristales bioactivos como el fosfato tricálcico y la hidroxiapatita. Los materiales de injerto aloplástico generalmente se consideran únicamente osteoconductivos, sin propiedades osteoinductivas.34,35
En el estudio de Schmitt y cols., 2013 el empleo de hueso autólogo permitió obtener una mayor cantidad de hueso nuevo a los 5 meses frente a aloinjerto, injerto aloplástico y xenoinjerto21. Del mismo modo, en el estudio de Danesh-Sani y cols., 2016, la cantidad de hueso nuevo fue mayor en el grupo en el que se empleó hueso autólogo frente a aloplástico17.
Al comparar los resultados obtenidos entre material aloplástico y aloinjerto, no se encontraron diferencias significativas en los estudios incluidos en esta revisión.15 Del mismo modo, en el único estudio incluido donde se comparan los valores obtenidos entre xenoinjerto y material aloplástico, no se obtuvieron diferencias significativas.10 Sin embargo, sí se observaron diferencias entre xenoinjerto versus aloinjerto, obteniéndose una mayor formación con este último21.
El PRP se ha propuesto como un instrumento útil para aumentar la calidad y cantidad final del hueso regenerado en la cirugía oral y maxilofacial combinado con los materiales de injerto mencionados previamente. Sin embargo, la literatura es contradictoria con respecto al uso adyuvante de PRP en el aumento de seno. Los factores que pueden contribuir a esta conclusión son la variabilidad en los diseños de los estudios, los diferentes rendimientos de plaquetas y los diferentes métodos de cuantificación de la regeneración ósea y la cicatrización de heridas. El uso de PRP se basa en la premisa teórica de que, al concentrar las plaquetas, aumentarán los efectos de los factores de crecimiento liberados (PDGF, TGF-β, IGF-I e IGF-II).36 Pese a las ventajas que parecen presentar los concentrados plaquetarios, en el estudio de Nizam y cols., 2018 en donde se compara el empleo de Bio-Oss® junto con L-PRF frente al uso solo de Bio-Oss® los resultados obtenidos no fueron estadísticamente significativos.13 Lo mismo ocurrió en el estudio de Killiç y cols., 2017 donde la combinación de TCP con P-PRP o TCP con PRF no permitió obtener resultados significativos frente al empleo solo de TCP14.
Otro factor de crecimiento bien conocido es la proteína morfogenética ósea (BMP-7), que es osteoinductora y puede tener el potencial de estimular a las células mesenquimales para que se diferencien en células formadoras de hueso. La combinación de esta proteína con algunos materiales de injerto se ha llevado a cabo en la práctica. Sin embargo, pese a su capacidad osteoinductora, al emplear BMP-7 en combinación con Bio-Oss®, se obtuvieron resultados menores en cuanto a la formación de hueso nuevo que el obtenido al emplear solo Bio-Oss®19.También se han utilizado la recreación de BMP-2 como proteína recombinante humana (rhMP2), y se ve en algunos estudios que mejora la calidad y cantidad del hueso en estos procedimientos.37,38 Sin embargo, Kao y cols., demostraron que el xenoinjerto solo, en comparación con la mezcla de xenoinjerto y rhBMP-2, condujo a la formación de más hueso nuevo en el seno maxilar39.
En revisiones sistemáticas y metaanálisis previos sobre los resultados histomorfométricos de diferentes materiales se determinó que el hueso autógeno solo puede inducir la mayor cantidad de NH en comparación con los otros materiales, a corto plazo (6 meses)32,33. Sin embargo, una combinación de hueso autógeno y xenoinjertos, así como xenoinjertos solos y mezclas de fosfato tricálcico e hidroxiapatita pueden representar alternativas válidas frente al hueso autógeno cuando la morbilidad del sitio donante es una preocupación31.
En el metanálisis de Al-Moraissi y cols., 2020 se determinó que con la aplicación de injertos óseos acelulares osteoconductivos solos, como xenoinjertos o aloplásticos se obtienen valores más bajos de hueso nuevo y más altos en injerto residual y tejido conectivo, en comparación con injertos óseos osteogénicos y/u osteoinductivos. El tiempo de cicatrización tiene un efecto destacado en la formación de hueso nuevo, especialmente cuando se utiliza un biomaterial caracterizado por una tasa de reabsorción lenta, como los xenoinjertos, que necesitan tiempos de curación más prolongados para lograr un NH alto en comparación con los materiales con una tasa de reabsorción más rápida. De hecho, en este estudio el hueso autógeno mostraba el mejor rendimiento sólo cuando el tiempo de cicatrización era inferior a 6 meses, mientras que durante un tiempo de cicatrización más prolongado la mayoría de los materiales lograban resultados histomorfométricos similares40.
La implicación clínica de este hallazgo viene relacionada con el momento de la colocación de los implantes: se recomienda el injerto de hueso autógeno cuando se planifica la rehabilitación implantológica dentro de los 6 meses posteriores a la regeneración. Además, la adición de hueso autógeno, factores de crecimiento o MSCs a cualquier biomaterial puede aumentar la tasa de curación. La combinación de materiales aloplásticos y hueso autógeno representa una alternativa satisfactoria al hueso autógeno solo para lograr un NH alto en combinación con una morbilidad reducida. Si la morbilidad del sitio de extracción es una preocupación, se pueden utilizar muchos materiales de injerto alternativos, ya que pueden lograr resultados similares a los de autoinjertos, pero se recomiendan tiempos de curación superiores a los 6 meses40.
El xenoinjerto de origen bovino (Bio-Oss) es uno de los materiales comúnmente utilizados en la elevación de seno maxilar, observándose que con el empleo de Bio-Oss® sólo se consiguen mayores valores NH que en combinación con fosfato cálcico y rhPDGF (entre los 7 y 9 meses de colocación)11,20. También se ha visto, que con la combinación de Bio-Oss® y MSCs se logra mayor cantidad de hueso nuevo formado que cuando se combina Bio-Oss® con hueso autólogo25.
Los sustitutos óseos de origen aloplástico, los xenoinjertos, los aloinjertos y el propio hueso autólogo son materiales de injerto adecuados para la cirugía de elevación de seno mediante técnica abierta o de ventana lateral. Actualmente, el hueso autólogo sigue considerándose el gold standard en la regeneración ósea por sus propiedades osteogénicas. Sin embargo, los otros tres injertos de diferente naturaleza pueden llegar a ser casi tan eficaces, logrando una formación de hueso nuevo bastante aproximada y apropiada para la colocación de implantes de forma diferida tras la elevación de seno maxilar.
Entre las limitaciones que presenta esta revisión se encuentra que únicamente se incluyeron artículos publicados en los últimos diez años y en lengua inglesa. Además, las diferencias en el diseño de los estudios incluidos en esta revisión dificulta la comparación de los resultados entre estudios. Por ello, se necesitan más estudios sobre el tema con una metodología más homogénea para poder obtener conclusiones más contundentes.
En estudios histomorfométricos se ha observado que el empleo de hueso autólogo como biomaterial en la cirugía de elevación de seno maxilar mediante técnica abierta, obtiene el mayor porcentaje de hueso nuevo formado. Sin embargo, dada la morbilidad asociada a su empleo, la utilización de aloinjerto, xenoinjerto y sustitutos óseos aloplásticos o compuestos, resultan una buena alternativa, ya que la neoformación ósea conseguida es aproximadamente similar a la lograda con el hueso autólogo. Sin embargo, se necesita una mayor cantidad de ensayos clínicos randomizados en los que se incluya un mayor tamaño muestral y periodos de seguimiento más amplios.
Danesh-Sani SA, Loomer PM, Wallace SS. A comprehensive clinical review of maxillary sinus floor elevation: anatomy, techniques, biomaterials and complications. Br J Oral Maxillofac Surg 2016;54(7):724-30.
Woo I, Le BT. Maxillary sinus floor elevation: review of anatomy and two techniques. Implant Dent 2004;13(1):28-32.
Iwanaga J, Wilson C, Lachkar S, Tomaszewski K, Walocha J. Shane Tubbs S. Clinical anatomy of the maxillary sinus: application to sinus floor augmentation. Anat Cell Biol 2019; 52:17-24.
Misch CE. Contemporary Implant Practise. 3ªed. St. Louis: Mosby Elsevier; 2008.
Misch CE. Prótesis dental sobre implantes. 2ª ed. España: Elsevier; 2015.
Yilmaz S, Karaca EO, Ipci SD, y cols., Radiographic and histologic evaluation of platelet-rich plasma and bovinederived xenograft combination in bilateral sinus augmentation procedure. Platelets 2013;24(4):308-15.
Boyne PJ, James RA: Grafting of the maxillary sinus floor with autogenous marrow and bone. J Oral Surg 1980;38(8):613-616.
Tatum H Jr: Maxillary and sinus implant reconstructions. Dentistry Clinical North America 1986, 30:207-229.
Summers RB. The osteotome technique: Part 3–Less invasive methods of elevating the sinus floor. Compendium 1994;15(6):698, 700, 702-4 passim; quiz 710.
Kraus RD, Stricker A, Thoma DS, Jung RE. Sinus Floor Elevation with Biphasic Calcium Phosphate or Deproteinized Bovine Bone Mineral: Clinical and Histomorphometric Outcomes of a Randomized Controlled Clinical Trial. Int J Oral Maxillofac Implants 2020;35(5):1005-1012.
Pang K-, Lee J-, Choi S-, Kim Y-, Kim B-, Lee J-. Maxillary Sinus Augmentation with Calcium Phosphate Double-Coated Anorganic Bovine Bone: Comparative Multicenter Randomized Clinical Trial with Histological and Radiographic Evaluation. Implant Dent 2019;28(1):39-45.
La Monaca G, Iezzi G, Cristalli MP, Pranno N, Sfasciotti GL, Vozza I. Comparative Histological and Histomorphometric Results of Six Biomaterials Used in TwoStage Maxillary Sinus Augmentation Model after 6-Month Healing. Biomed Res Int 2018 27;2018:9430989.
Nizam N, Eren G, Akcal A, Donos N. Maxillary sinus augmentation with leukocyte and platelet-rich fibrin and deproteinized bovine bone mineral: A split-mouth histological and histomorphometric study. Clin Oral Implants Res 2018;29(1):67-75.
Kiliç SC, Guengoermues M, Parlak SN. Histologic and histomorphometric assessment of sinus-floor augmentation with beta-tricalcium phosphate alone or in combination with pure-plateletrich plasma or platelet-rich fibrin: A randomized clinical trial. Clin Implant Dent Relat Res 2017;19(5):959-967.
Kolerman R, Nissan J, Rahmanov M, Vered H, Cohen O, Tal H. Comparison between mineralized cancellous bone allograft and an alloplast material for sinus augmentation: A split mouth histomorphometric study. Clin Implant Dent Relat Res 2017;19(5):812-820.
Ahmet S, Alper Gultekin B, Karabuda ZC, Olgac V. Two Composite Bone Graft Substitutes for Maxillary Sinus Floor Augmentation: histological, Histomorphometric, and Radiographic Analyses. Implant dentistry 2016;25(3):313-321.
Danesh-Sani SA, Wallace SS, Movahed A, El Chaar ES, Cho SC, Khouly I, Testori T. Maxillary sinus grafting with biphasic bone ceramic or autogenous bone: Clinical, histologic, and histomorphometric results from a randomized controlled clinical trial. Implant Dent 2016;25(5):588- 93.
Bassil J, Naaman N, Lattouf R, y cols., Clinical, histological, and histomorphometrical analysis of maxillary sinus augmentation using inorganic bovine in humans: preliminary results. J Oral Implantol 2013;39(1):73-80.
Corinaldesi G, Piersanti L, Piattelli A, Iezzi G, Pieri F, Marchetti C. Augmentation of the floor of the maxillary sinus with recombinant human bone morphogenetic protein-7: a pilot radiological and histological study in humans. Br J Oral Maxillofac Surg 2013;51(3):247-252.
Froum SJ, Wallace S, Cho SC, Rosenburg E, Froum S, Schoor R, y cols., A histomorphometric comparison of Bio-Oss alone versus Bio-Oss and platelet-derived growth factor for sinus augmentation: a postsurgical assessment. Int J Periodontics Restorative Dent 013;33(3):269-279.
Schmitt CM, Doering H, Schmidt T, Lutz R, Neukam FW, Schlegel KA. Histological results after maxillary sinus augmentation with Straumann® BoneCeramic, BioOss®, Puros®, and autologous bone. A randomized controlled clinical trial. Clin Oral Implants Res 2013;24(5):576-85.
Dasmah A, Hallman M, Sennerby L, Rasmusson L. A clinical and histological case series study on calcium sulfate for maxillary sinus floor augmentation and delayed placement of dental implants. Clin Implant Dent Relat Res 2012;14(2):259-65.
Avila-Ortiz G, Neiva R, GalindoMoreno P, Rudek I, Benavides E, Wang HL. Analysis of the influence of residual alveolar bone height on sinus augmentation outcomes. Clin Oral Implants Res 2012;23(9):1082-8.
Barone A, Ricci M, Covani U, Nannmark U, Azarmehr I, Calvo-Guirado JL. Maxillary sinus augmentation using prehydrated corticocancellous porcine bone: hystomorphometric evaluation after 6 months. Clin Implant Dent Relat Res 2012;14(3):373-9.
Rickert D, Sauerbier S, Nagursky H, Menne D, Vissink A, Raghoebar GM. Maxillary sinus floor elevation with bovine bone mineral combined with either autogenous bone or autogenous stem cells: A prospective randomized clinical trial. Clin Oral Implants Res 2011;22(3):251-258.
Chaushu G, Vered M, Mardinger O, Nissan J. Histomorphometric analysis after maxillary sinus floor augmentation using cancellous bone-block allograft. J Periodontol 2010;81(8):1147-52.
de Vicente JC, Hernández-Vallejo G, Braña-Abascal P, Peña I. Maxillary sinus augmentation with autologous bone harvested from the lateral maxillary wall combined with bovine-derived hydroxyapatite: clinical and histologic observations. Clin Oral Implants Res 2010; 1;21(4):430-8.
Block MS, Kent JN. Sinus augmentation for dental implants: the use of autogenous bone. J Oral Maxillofac Surg 1997;55:1281–6.
Schlegel KA, Fichtner G, SchultzeMosgau S, Wiltfang J. Histologic findings in sinus augmentation with autogenous bone chips versus a bovine bone substitute. Int J Oral Maxillofac Implants 2003;18:53–8.
Monzón Trujillo D, Martínez Brito I, Rodríguez Sarduy R, Piña Rodríguez JJ, Pérez Mír EA. Injertos óseos en implantología oral. Rev Medica Electronica 2014;36(4).
Corbella S, Taschieri S, Weinstein R, Del Fabbro M. Histomorphometric outcomes after lateral sinus floor elevation procedure: a systematic review of the literature and meta-analysis. Clin Oral Implants Res 2016; 27(9):1106–1122.
Handschel J, Simonowska M, Naujoks C, Depprich RA, Ommerborn MA, Meyer U, Kubler NR. A histomorphometric metaanal-ysis of sinus elevation with various grafting materials. Head Face Med 2009;5:12.
Danesh-Sani SA, Engebretson SP, Janal MN. Histomorphometric results of different grafting materials and effect of healing time on bone maturation after sinus floor augmenta-tion: a systematic review and meta-analysis. J Periodontal Res 2017;52:301–12.
Danesh-Sani SA, Loomer PM, Wallace SS. A comprehensive clinical review of maxillary sinus floor elevation: anatomy, techniques, biomaterials and complications. Br J Oral Maxillofac Surg 2016;54(7):724-30.
Martinez Alvarez O, Barone A, Covani U, Fernández Ruiz A, Jiménez Guerra A, Monsalve Guil L, Velasco Ortega E. Injertos óseos y biomateriales en implantología oral. Avances en Odontoestomatología 2018; 34(2): 111-119.
Browaeys H, Bouvry P, De Bruyn H. A literature review on biomaterials in sinus augmentation procedures. Clin Implant Dent Relat Res 2007;9(3):166-77.
Boyne PJ, Lilly LC, Marx RE, et al. De novo bone induction by recombinant human bone morphogenetic protein-2 (rhBMP-2) in maxillary sinusfloor augmentation. J. Oral Maxillofac. Surg 2005;63:1693–707.49
Triplett RG, Nevins M, Marx RE, et al. Pivotal, randomized, parallel evaluation of recombinant human bone morphogenetic protein-2/absorbable collagen sponge and autogenous bone graft for maxillary sinus floor augmentation. J. Oral Maxillofac Surg 2009;67:1947–60
Kao DW, Kubota A, Nevins M, et al. The negative effect of combiningrhBMP-2 and Bio-Oss on bone formation for maxillary sinus augmentation. Int J Periodontics Restorative Dent 2012;32:61–7.
Al-Moraissi EA, Alkhutari AS, Abotaleb B, Altairi NH, Del Fabbro M. Do osteoconductive bone substitutes result in similar bone regeneration for maxillary sinus augmentation when compared to osteogenic and osteoinductive bone grafts? A systematic review and frequentist network meta-analysis. Int J Oral Maxillofac Surg 2020;49(1):107-120.

Serrano Zamora, Rebeca
Graduada en Odontología, Universidad Complutense de Madrid. Especialista en Medicina Oral, Universidad Complutense de Madrid. Alumna del Máster Universitario en Ciencias Odontológicas, Universidad Complutense de Madrid.
Ochoa-López, Gastón
Graduado en Odontología, Universidad Complutense de Madrid. Máster en Prótesis sobre Implantes, Universidad Rey Juan Carlos. Alumno del Máster Universitario en Ciencias Odontológicas, Universidad Complutense de Madrid.
Iglesias Velázquez, Óscar
Graduado en Odontología, Universidad Complutense de Madrid. Especialista en Medicina Oral, Universidad Complutense de Madrid. Alumno del Máster de Cirugía Bucal e Implantología, Universidad Complutense de Madrid.
Sánchez Labrador, Luis
Profesor del Máster en Cirugía Bucal e Implantología, Facultad de Odontología. Universidad Complutense de Madrid.
González FernándezTresguerres, Francisco
Profesor del Máster en Cirugía Bucal e Implantología, Facultad de Odontología. Universidad Complutense de Madrid.
Meniz García, Cristina
Profesor Contratado Doctor del Departamento de Especialidades Clínicas Odontológicas, Facultad de Odontología, Universidad Complutense de Madrid.