Revisión bibliográfica
Kewalramani Kewalramani N, Peña Cardelles JF, Ortega Concepción D, López Carpintero A, Arnau Vidal A, Perrone G. Efectividad de las células madre mesenquimales en las elevaciones de seno maxilar. Revisión de la literatura. Cient. Dent. 2021; 18; 3; 159-164
Efectividad de las células madre mesenquimales en las elevaciones de seno maxilar. Revisión de la literatura
Actualmente, la implantología está considerada como la terapia de elección para rehabilitar dientes ausentes. Sin embargo, debido a diversos factores, no siempre se consigue un enfoque inmediato para la colocación de los implantes. Se debe prestar una atención especial a los sectores maxilares posteriores, que debido al paso del tiempo y a la ausencia de dientes, sufren una gran atrofia alveolar que se encuentra asociada a una expansión del seno maxilar que dificulta, en ocasiones, la rehabilitación con implantes osteointegrados. Debido a esta pérdida ósea, se han desarrollado técnicas quirúrgicas como la elevación de seno maxilar para obtener una ganancia de hueso y poder favorecer la colocación y el pronóstico de los implantes. Sin embargo, existen situaciones en las que incluso esta técnica no aporta un volumen óseo suficiente, siendo preciso acompañarla de técnicas de regeneración ósea.
En la actualidad, existen estudios que plantean el uso de células madre mesenquimales en procedimientos de regeneración ósea como alternativa a los procedimientos convencionales.
El objetivo del presente trabajo es evaluar a través de la realización de una revisión sistemática de la literatura, la efectividad de las células madres mesenquimales en elevaciones de seno maxilar con diferentes tipos de matriz ósea.
Currently, implantology is considered the therapy of choice to rehabilitate missing teeth. However, due to various factors, we do not always get an immediate approach to the placement of our implants. Above all, we must pay special attention to the posterior maxillary sectors, which due to the passage of time and the absence of dental pieces suffer great alveolar atrophy associated with an expansion of the maxillary sinus that makes difficult and sometimes impossible the implant therapy. Due to this great bone loss, the professionals have been forced to practice surgical techniques such as maxillary sinus lift to gain bone and to be able to favour the placement and prognosis of the implants. However, there are clinical situations in which even this technique does not give us sufficient bone volume, being necessary a bone regeneration therapy.
Thus, thanks to advances in the field of scientific research, various methods have been used to solve this type of problem, but one of the most innovative and current options is bone regeneration using mesenchymal stem cells.
This work aims to evaluate, carrying out a systematic review of the literature, the effectiveness of mesenchymal stem cells in maxillary sinus elevations with several types of matrix.
Actualmente, el paciente desdentado parcial o total, demanda rehabilitaciones protésicas que cumplan los requisitos de estética, función (masticatoria y fonética) y comodidad.
La implantología oral está considerada como la terapia de elección para reemplazar dientes ausentes y el porcentaje de éxito, actualmente, es del 95-98%1 ; pero no siendo una terapia perfecta se está intentando continuamente unir el deseo común de profesionales y pacientes, de disminuir el traumatismo físico que conlleva.
La colocación de implantes dentales lleva asociado consigo en ocasiones, procedimientos de reconstrucción o regeneración ósea y de tejidos blandos. Esto ocurre debido a que en distintas zonas orales, pero con más frecuencia en los sectores posteriores del maxilar, ocurre una atrofia alveolar secundaria a la pérdida dentaria que se asocia a una expansión del seno maxilar, quedando poco hueso disponible para la colocación del implante2 .
Hoy en día, la elevación del seno maxilar se ha convertido en un procedimiento fiable y comúnmente utilizado para aumentar el volumen óseo en el maxilar posterior3
Durante mucho tiempo, el hueso autólogo ha sido el gold standard en la cirugía de elevación de seno4 . De hecho, el hueso autólogo exhibe el potencial osteogénico y osteocondutor, ya que contiene células vivas y factores de crecimiento del mismo paciente. Las limitaciones de este tipo de injerto son principalmente dos: la disponibilidad limitada con el consecuente aumento de la morbilidad en el sitio donante y la reabsorción significativa que sufre este tipo de injerto sobre todo en grandes defectos óseos5 .
Para afrontar estas dificultades se han introducido en el mercado nuevos materiales de injertos como el aloinjerto, el xenoinjerto y los materiales sintéticos, que aunque no incluyen células vivas sufren una menor reabsorción que el hueso autólogo.
Según la ingeniería de tejidos óseos, un sustituto óseo debe tener características biológicas y morfológicas tan similares, como sea posible, a un hueso autólogo, y la fabricación del injerto óseo ideal requiere la presencia de tres elementos esenciales: poder osteogénico, factores de crecimiento y poder osteoconductivo6 . En particular, la ingeniería de tejidos óseos tiene como objetivo lograr el aumento óseo sin la recolección quirúrgica de hueso autólogo de otros sitios donantes (que aumenta la morbilidad del paciente) a través del uso de injertos específicos sembrados con células madre mesénquimales (CMMs) adultas.
Una célula madre es una célula indiferenciada con la capacidad de renovarse y obtener un fenotipo celular específico si se expone a estímulos adecuados. Los tipos de células madre más relevantes en las investigaciones clínicas son las células madre embrionarias (CMEs) típicas de blastocitos embrionarios, y las células madre adultas, también llamadas CMMs pluripotentes7 .
Las células madre embrionarias tienen un potencial ilimitado de proliferación y son capaces, en condiciones de inducción adecuadas, de producir las tres capas germinales de fenotipos celulares. Las CMEs pueden cultivarse indefinidamente in vitro durante más de dos años, con aproximadamente 400 ciclos de duplicación, sin pérdida de potencial de diferenciación8 . Pueden ser reintroducidas en un embrión huésped dando lugar a progenies que se diferencian en todo tipo de tejidos. El uso de estas células, presenta los riesgos potenciales de inmunoreacción o teratógenesis. Por otra parte, a pesar de la pluripotencia de las CMEs, las controversias morales y legales sobre su uso, para la aplicación terapéutica y clínica, han convertido la búsqueda sobre depósitos de células progenitoras en los tejidos adultos9 .
Las células madre adultas pluripotentes, derivadas de diferentes tejidos, tienen una amplia auto-renovación y proliferación, mientras que si se estimulan correctamente tienen la capacidad de diferenciarse en células específicas. Aunque las CMMs muestran una vida útil limitada y senescencia más rápida que las CMEs, las técnicas in vitro actuales permiten duplicarlas en un número suficiente para la utilización y el mantenimiento del fenotipo indiferenciado. Las células madres mesenquimales carecen de características inmunogénicas o tumorígenas. Además, no existe ninguna preocupación ética o jurídica en el uso clínico de células madre mesenquimales (CMMs). Por todas estas razones, estas células pueden ser utilizadas en enfoques basados en regeneración ósea10.
Las CMMs pueden extraerse de diferentes tejidos, como la médula ósea [células madre de la médula ósea], periostio (células madre derivadas del periostio), hueso trabecular, tejido adiposo [vástago adiposo], el cordón umbilical, el líquido amniótico [células madre del líquido amniótico y las células madre epiteliales amnióticas], la piel, la pulpa dental (células madre de pulpa dental), los dientes caducifolios y el ligamento periodontal [células madre de ligamento periodontal]11.
El objetivo de este trabajo es evaluar, a través de una revisión literaria de los estudios hasta ahora publicados sobre este tema, la eficacia de la utilización de células madres mesenquimales adultas junto a varias tipologías de matriz en las elevaciones de seno maxilar.
Evaluar la efectividad de las células madres mesenquimales en elevaciones de seno maxilar con diferentes tipologías de matriz.
Para la realización de esta revisión literaria se estableció una pregunta para responderla con el desarrollo de esta investigación. Esta pregunta es: ¿son las células madre mesenquimales efectivas en los procedimientos de elevación del seno maxilar?
Estrategia de búsqueda
Se realizó una búsqueda exhaustiva de la literatura desde el 1 de enero de 2008 hasta el 2 de febrero de 2018 en las siguientes bases de datos: Pubmed/MEDLINE, Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials), EMBASE. La estrategia de búsqueda utilizó la siguiente combinación de términos: Mesenchymal stem cells AND bone regeneration OR Maxillary sinus floor augmentation AND bone marrow AND surgery AND stromal cells. Se realizó una búsqueda manual adicional para encontrar posibles estudios elegibles.
Selección de estudios
Criterios de inclusión. Se incluyeron los artículos a texto completo publicados entre 2008 y 2018. Sólo se seleccionaron los artículos a texto completo publicados en inglés o español. En los estudios incluidos, la intervención llevada a cabo en los mismos debe informar sobre elevación de seno maxilar con células madres mesenquimales y estudiar los parámetros clínicos de aumento de hueso radiológico (histomorfometría) y tiempo de cicatrización. Solo se seleccionaron estudios en humanos.
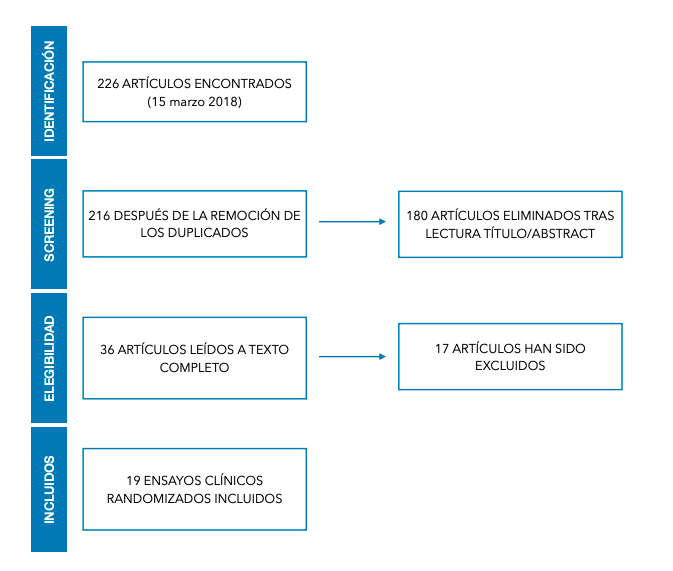
Criterios de exclusión. No se incluyeron los artículos publicados antes de 2008, en un idioma distinto al inglés o al español o que no estuvieran disponibles en texto completo. También se excluyeron los estudios que evaluaban otros tipos de intervenciones de elevaciones de seno y los estudios sin grupo control. En la figura se refleja el diagrama de flujo.
La búsqueda obtuvo como resultado un total de 226 artículos y mediante un screening de títulos y abstract se han excluido 180 artículos (Figura). Además, 10 de ellos, se eliminaron por duplicidad. Los 36 artículos remanentes, fueron leídos a texto completo.
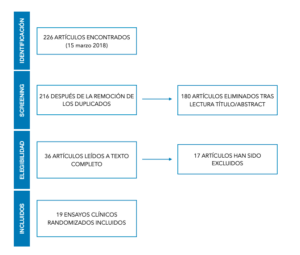
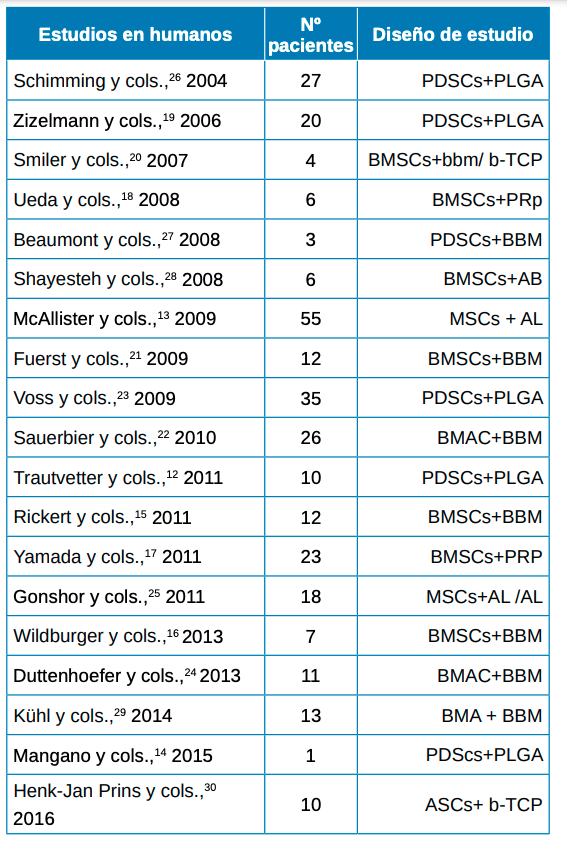
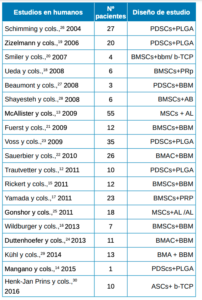
Finalmente, se incluyeron un total de 19 estudios sobre humanos con diferentes tipos de combinaciones según los criterios de inclusión (Tabla): Trautvetter y cols.,12, McAllister y cols.,13,Mangano y cols.,14, Rickert y cols.,15, Wildburger y cols.,16, Yamada y cols.,17, Ueada y cols.,18, Zizelmann y cols.,19, Smiler y cols.,20, Fuerst y cols.,21, Sauerbier y cols.,22, Voss y cols.,23, Duttenhoefer y cols.,24, Gonshor y cols.,25, Schimming y cols.,26, Beaumont y cols.,27,Shayesteh y cols.,28, Kühl y cols.,29, Henk-Jan Prins y cols.,30.
Sobre los datos descritos en humanos se han encontrado muchas discrepancias entre los sucesos obtenidos en animales y en humanos. Esto probablemente se debe a que han entrado en juego elementos que no se han podido controlar como, por ejemplo, los hábitos del paciente o la técnica del profesional. En general, se han obtenido mejores resultados con el empleo de BMSCs en combinación con hueso bovino (BBM), ya que el xenoinjerto bovino mantiene bien la estructura tisular del hueso en la zona con consecuente mejoría en la osteoformación. En un futuro una mejoría en el material de la matriz y los avances en regeneración ósea permitirán beneficios en esta prometedora técnica. Sería necesario evaluar también el coste beneficio de esta técnica basada en células mesenquimales.
McAllister y cols.,13 evaluaron la formación de hueso después de la elevación de seno empleando un aloinjerto que contiene células madre. Después de un período de cicatrización de 4 meses, se realizó una biopsia y una evaluación histológica. La evaluación histológica e histomorfométrica de los cinco casos reportados reveló un alto porcentaje de contenido óseo vital, después de un período de cicatrización relativamente corto .
Por otro lado, el estudio clínico de Gonshor y cols.,25 evaluó la formación de hueso en elevaciones de seno utilizando como injerto óseo un aloinjerto en combinación con células madre y se comparó con su uso únicamente de aloinjerto, obteniendo como resultado una diferencia significativa entre ambos grupos.
Se debe destacar que los estudios en seres humanos sobre células madres mesenquimales en combinación con hueso bovino no han confirmado los excelentes resultados originalmente obtenidos en los estudios en animales. Duttenhoefer y cols.,24 concentraron células madre mesenquimales con aspirado de médula ósea (MSCs + BMAC) (grupo de ensayo, n = 12 elevaciones de seno) y se transplantaron en combinación con BBM. Se colocaron 50 implantes dentales con diferentes procedimientos quirúrgicos y resultaron no ser eficientes porque la diferencia entre los grupos no fue estadísticamente significativa.
En un estudio radiográfico, Kühl y cols.,29 investigaron la composición de BMAC sobre la estabilidad de los materiales de injerto cuando se agregaron a BBM dentro de los primeros 6 meses después de una elevación de seno. Utilizando un software de reconstrucción en 3D, se procesaron datos del escáner de 13 pacientes sometidos a elevaciones de seno bilaterales en un estudio de boca partida, para evaluar los volúmenes de injerto a 2 semanas y 6 meses tras el procedimiento de elevación de seno. La comparación entre los volúmenes de 2 semanas y 6 meses mostró una disminución estadísticamente significativa en todos los grupos individuales entre el 15% y el 21%. Sin embargo, los cambios en los volúmenes entre los diferentes grupos no fueron estadísticamente significativos. En un estudio con un diseño a boca partida también, Wildburger y cols., 16 evaluaron la formación ósea mediante la utilización de hueso bovino (BBM) y células estromales de la médula (BMSCs) en las elevaciones de seno en el grupo de ensayo, a los 3 y a los 6 meses. Siete pacientes, con la presencia de atrofia ósea en el maxilar posterior se incluyeron en este estudio. Los procedimientos de aumento se realizaron con células BMSC mezcladas con BBM. Los pacientes pertenecientes al grupo control fueron sometidos al mismo procedimiento pero únicamente con injertos de BBM. A los 3 y 6 meses, se tomaron biopsias. La evaluación histológica/histomorfométrica no encontró diferencias significativas en la formación de hueso nuevo entre el grupo test y el grupo de control.
Rickert y cols.,15 describieron cómo las células estromales de la médula (BMSCs) sembradas en partículas de BBM podrían generar un volumen óseo mayor y adecuado para permitir a los odontólogos colocar implantes en comparación al uso de hueso autólogo (AB) o una mezcla de AB + BBM. La lenta tasa de reabsorción del BBM permite una adecuada integración ósea antes de la reabsorción de la matriz. Sin embargo, la tasa de material no mineralizado es generalmente alta, incluso 6 meses después del procedimiento de regeneración.
El estudio anterior coincide con los resultados de un estudio multicéntrico anterior, controlado por Sauerbier y cols.,22 en el que encontraron que el concentrado de aspiración de médula ósea en combinación con BBM o AB + BBM, empleados en las elevaciones de seno, dan valores similares de formación ósea tras 3-4 meses de cicatrización.
Fuerst y cols.,21 examinaron los resultados histológicos / histomorfométricos y radiológicos 12 meses después de una elevación de seno con células óseas autólogas expandidas en cultivo en combinación con BBM. En total, se realizaron 22 elevaciones de seno en 12 pacientes con células óseas autólogas expandidas en cultivo sembradas con BBM. A pesar de una reducción considerable del volumen del injerto a lo largo del tiempo, las células de hueso autólogo (AB) y BBM proporcionaron un volumen óseo adecuado, lo que permitió la colocación del implante y el hueso formado toleró la carga.
En otro estudio reciente de Shayesteh y cols.,28 se empleó CPC en combinación con BMSC en elevaciones de seno. Seis pacientes se sometieron a esta intervención con BMSC + AB / beta-TCP. 3 y 12 meses después de la elevación de seno, se realizó una evaluación radiográfica. En total, se colocaron 30 implantes y se tomó una biopsia de cada lecho óseo. La rehabilitación protésica se realizó después de 4 meses. La tasa de éxito de los implantes fue del 93% (28 implantes de 30). La evaluación histológica mostró varias áreas de formación osteoide. La regeneración ósea media fue del 41,34%. No se observaron complicaciones clínicas.
Finalmente, un estudio de Smiler y cols.,20 evaluaron el efecto del aspirado de médula ósea en combinación con xenoinjerto o matriz de injerto aloplástico (beta-TCP) para mejorar la formación de hueso en elevaciones de seno. Los procedimientos clínicos implicaron la extracción de cuatro centímetos cúbicos de aspirado de médula ósea de la cresta ilíaca anterior. Las biopsias a los 4 meses mostraron, en andamios de beta-TCP, el 40% de un hueso recién formado completamente vital.
Varios estudios han demostrado el potencial de los enfoques basados en células madres mesenquimales adultas (MSCs) en elevaciones de seno maxilar. Sin embargo, no existen estudios que muestren diferencias estadísticamente significativas entre la elevación de seno maxilar llevada a cabo de manera convencional y la elevación de seno maxilar con el empleo de células madre mesenquimales. Aún así, existen estudios que ponen en relieve la presencia de un mayor volumen óseo en las elevaciones de seno con células madre mesenquimales y, por ello, se necesita un mayor número de ensayos clínicos aleatorizados, sobre todo con muestras de mayor tamaño, para confirmar estos resultados.
Brånemark PI, Adell R, Albrektsson T, Lekholm U, Lindström J, Rockler B. An experimental and clinical study of osseointegrated implants penetrating the nasal cavity and maxillary sinus. J Oral Maxillofac Surg 1984; 42(8): 497-505.
Krennmair G Seemann R, Schmidinger S, Ewers R, Piehslinger E. Clinical outcome of root-shaped dental implants of various diameters: 5-year results. Int J Oral Maxillofac Implants 2010; 25: 357- 66.
Duttenhoefer F, Souren C, Menne D, Emmerich D, Schön R, Sauerbier S. Long-term survival of dental implants placed in the grafted maxillary sinus: systematic review and meta-analysis of treatment modalities. PLoS One 2013; 8: p.e75357.
Bertolai R, Catelani C, Aversa A, Rossi A, Giannini D, Bani D. Bone graft and mesenchimal stem cells: clinical observations and histological analysis. Clin Cases Miner Bone Metab 2015; 12(2): 183-7.
Garg AK. Augmentation grafting of the maxillary sinus for placement of dental implants: anatomy, physiology, and procedures. Implant Dent 1999; 8(1): 36- 46.
Ramirez J, Bai Q, Dijon-Grinand M, y cols. Human pluripotent stem cells: from biology to cell therapy. World J Of Stem Cells 2010; 2(2): 24-33.
Handschel J, Wiesmann HP, Depprich R, Kübler NR, Meyer U. Cell- based bone reconstruction therapies–cell sources. Int J Of Oral Maxillofac Implants 2006; 21: 890-898.
Bifari F, Pacelli L, Krampera M. Immunological properties of embryonic and adult stem cells. World J Of Stem Cells 2010; 2: 50-60.
Daar AS, Sheremeta L. The science of stem cells: ethical, legal and social issues. Experimental and clinical transplantation. Exp Clin Transplant 2003;1:139-46.
Murphy CM, O’Brien FJ, Little DG, Schindeler A. Cell-scaffold interactions in the bone tissue engineering triad. Eur Cell Mater 2013; 26: 120-32.
Sununliganon L, Peng L, Singhatanadgit W, Cheung LK. Osteogenic efficacy of bone marrow concentrate in rabbit maxillary sinus grafting. J Cranio-Maxill Surg 2014; 42: 1753-65.
Trautvetter W, Kaps C, Schmelzeisen R, Sauerbier, S, Sittinger M. Tissueengineered polymer-based periosteal bone grafts for maxillary sinus augmentation: five-year clinical results. J Oral Maxillofac Surg 2011; 69: 2753-62.
McAllister BS, Haghighat K, Gonshor A. Histologic Evaluation of a Stem Cell– Based Sinus-Augmentation Procedure. J Periodontol 2009; 80: 679-86.
Mangano C, Piattelli A, Tettamanti L y cols. Engineered bone by autologous osteoblasts on polymeric scaffolds in maxillary sinus augmentation: histologic report. J Oral Implantol 2010; 36: 491-6.
Rickert D, Slater JH, Meijer HJA, Vissink A, Raghoebar GM. Maxillary sinus lift with solely autogenous bone compared to a combination of autogenous bone and growth factors or (solely) bone substitutes. A systematic review. Int J Oral Maxillofac Surg 2012; 41: 160-7.
Wildburger A, Payer M, Jakse N, Strunk D, Etchard-Liechtenstein N, Sauerbier S. Impact of autogenous concentrated bone marrow aspirate on bone regeneration after sinus floor augmentation with a bovine bone substitute–a split-mouth pilot study. Clin Oral Implants Res 2014; 25: 1175-81.
Yamada Y, Nakamura S, Ueda M, Ito K. Osteotome technique with injectable tissue-engineered bone and simultaneous implant placement by cell therapy. Clin Oral Implants Res 2013; 24: 468-74.
Ueda M, Yamada Y, Kagami H, Hibi H. Injectable bone applied for ridge augmentation and dental implant placement: human progress study. Implant Dent 2008; 17: 82-90.
Zizelmann C, Schoen R, Metzger MC y cols. Bone formation after sinus augmentation with engineered bone. Clin Oral Implants Res: 2007; 18: 69-73.
Smiler D, Soltan M, Lee JW. A histomorphogenic analysis of bone grafts augmented with adult stem cells. Implant Dent 2007; 16: 42-53.
Fuerst G, Strbac GD, Vasak C y cols. Are culture-expanded autogenous bone cells a clinically reliable option for sinus grafting? Clin Oral Implants Res 2009; 20: 135-9.
Sauerbier S, Stubbe K, Maglione M y cols. Mesenchymal stem cells and bovine bone mineral in sinus lift procedures-an experimental study in sheep. Tissue Eng Part C: Methods 2010; 16: 1033-9.
Voss P, Sauerbier S, Wiedmann-AlAhamad M y cols. Bone regeneration in sinus lifts: comparing tissue-engineered bone and iliac bone. Br J Oral Maxillofac Surg 2010; 48: 121-6.
Duttenhoefer F, Souren C, Menne D, Emmerich D, Schön R, Sauerbier S. Long-term survival of dental implants placed in the grafted maxillary sinus: systematic review and meta-analysis of treatment modalities. PLoS One 2013; 8: 75357.
Gonshor A, McAllister BS, Wallace SS, Prasad H. 2011. Histologic and histomorphometric evaluation of an allograft stem cell-based matrix sinus augmentation procedure. Int J Oral Maxillofac Implants 2011; 26: 123-31.
Schimming R, Schmelzeisen R. Tissueengineered bone for maxillary sinus augmentation. J Oral Maxillofac Surg 2004; 62: 724-9.
Beaumont C, Schmidt RJ, Tatakis DN, Zafiropoulos GG. Use of engineered bone for sinus augmentation. J Periodontol 2008; 79: 541-48.
Shayesteh YS, Khojasteh A, Soleimani M, Alikhasi M, Khoshzaban A, Ahmadbeigi N. Sinus augmentation using human mesenchymal stem cells loaded into a β-tricalcium phosphate/hydroxyapatite scaffold. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 106: 203-9.
Kühl S, Payer M, Kirmeier R, Wildburger A, Wegscheider W, Jakse N. The influence of bone marrow aspirates and concentrates on the early volume stability of maxillary sinus grafts with deproteinized bovine bone mineral–first results of a RCT. Clin Oral Implants Res 2014; 25: 221-5.
Prins HJ, Schulten EA, Ten Bruggenkate CM, Klein-Nulend J, Helder MN. Bone regeneration using the freshly isolated autologous stromal vascular fraction of adipose tissue in combination with calcium phosphate ceramics. Stem Cells Transl Med 2016; 5:1362-74.

Kewalramani Kewalramani, Naresh
Colaborador Honorífico en Máster en Implantología avanzada, regeneración tisular y rehabilitación implantosoportada, Universidad Rey Juan Carlos. Máster en Ciencias Odontológicas, Universidad Complutense de Madrid.
Peña Cardelles, Juan Francisco
Profesor del Máster en Cirugía bucal e Implantología, Universidad Rey Juan Carlos.
Ortega Concepción, Daniel
Profesor del Máster en Cirugía bucal e Implantología, Universidad Rey Juan Carlos.
López Carpintero, Ángel
Director del Máster en Implantología avanzada, regeneración tisular y rehabilitación implantosoportada, Universidad Rey Juan Carlos. Máster en Periodoncia e Implantes, Universidad de Oviedo.
Arnau Vidal, Antonio
Alumno del Máster en Periodoncia, Universidad Santiago de Compostela. Máster en Ciencias Odontológicas, Universidad Complutense de Madrid.
Perrone, Giammarco
Máster en Implantología y Cirugía Oral, Universidad CEU. Máster en Ciencias Odontológicas, Universidad Complutense de Madrid.