Puesta al día
González Fernández-Tresguerres F, Serrano Zamora R, Baca González L, Iglesias Velázquez O, Xing Gao B, Fernández-Tresguerres Hernández-Gil I. Antiagregantes plaquetarios y cirugía oral: retirar o no retirar, esa es la cuestión. Cient. Dent. 2023; 20; 2; 79-90
Antiagregantes plaquetarios y cirugía oral: retirar o no retirar, esa es la cuestión
Las enfermedades cardiovasculares constituyen una de las patologías sistémicas más prevalentes en el mundo occidental. Muchos pacientes cardiópatas han tenido un episodio coronario agudo y están siendo tratados con antiagregantes plaquetarios. La terapia con estos fármacos puede suponer un reto para el odontólogo, que debe enfrentarse a un importante dilema: o mantener el fármaco, con el consiguiente riesgo hemorrágico, o retirarlo, con la posibilidad de que se produzcan complicaciones tromboembólicas, suponiendo un riesgo para la vida del paciente. Por ello, los odontólogos deberíamos conocer cuál debe ser el manejo de este tipo de pacientes ante la perspectiva de realizar un procedimiento quirúrgico en la cavidad oral o incluso una simple extracción dentaria.
Los objetivos de esta revisión narrativa son, en primer lugar, recordar la fisiología plaquetaria y los mecanismos de formación del trombo plaquetario; en segundo lugar, profundizar en los mecanismos de acción de los diferentes fármacos antiagregantes plaquetarios; y, en tercer lugar, ya que no existen guías clínicas al res- pecto, realizar un abordaje crítico de las pautas existentes para el manejo odontológico de este tipo de pacientes, en aras de prevenir la aparición de posibles complicaciones, no solo locales, sino, lo que es más importante, complicaciones sistémicas. En estos casos, antes de retirar la terapia antiagregante, convendría sopesar el riesgo hemorrágico versus el riesgo de generar un nuevo episodio tromboembólico, como puede ser la trombosis del stent o la recidiva del accidente coronario agudo, eventos que podrían poner en riesgo la vida del paciente.
Cardiovascular disease is one of the most prevalent systemic pathologies worldwide; those patients usually have had an acute coronary event which is treated with antiplatelet therapy. These drugs represent a challenge for the dentist, who must face a major dilemma: either maintain the drug, with the consequent bleeding risk, or withdraw it, with the possibility of thromboembolic complications, entailing a risk to the patient’s life. Therefore, dentists should know how to manage patients treated with these drugs when performing a surgical procedure or even a simple tooth extraction.
The objectives of this narrative review are, firstly, to recall platelet physiology and the mechanisms of platelet thrombus formation; secondly, to go more deeply into the mechanisms of action of the different antiplatelet drugs; and thirdly, since there are no clinical guidelines on this topic, to critically review the existing guidelines related to the dental management, in order to prevent the appearance of possible complications, not only local, but more importantly, systemic complications. In these cases, before interrupting antiplatelet therapy, the risk of bleeding should be evaluated against the risk of generating a new thromboembolic episode, such as stent thrombosis or recurrence of the acute coronary accident, events that could put the patient’s life at risk.
La enfermedad cardiovascular es la patología sistémica que genera mayor morbimortalidad en el mundo occidental. En España, según datos del Instituto Nacional de Estadística, en el año 2020, la patología cardiovascular fue la primera causa de muerte entre la población general, por delante de los tumores y de la COVID-19. En este sentido, la cardiopatía isquémica supone la principal causa de muerte en hombres y los accidentes cerebrovasculares en mujeres.
Dentro de las enfermedades cardiovasculares, la patología aterosclerótica es la principal causa de morbimortalidad en nuestro país, donde se incluyen los síndromes coronarios agudos, las enfermedades cerebrovasculares y la enfermedad arterial periférica1. El mecanismo etiopatogénico que subyace en todas estas patologías es la rotura de la placa de ateroma, que desencadena el fenómeno de la agregación plaquetaria, que es la causa del proceso trombótico agudo. Por ello, durante los últimos años, se han desarrollado nuevos fármacos antiagregantes plaquetarios, que constituyen la piedra angular de la prevención de la recurrencia de episodios isquémicos agudos, tanto a corto como a largo plazo. Estos fármacos merecen ser conocidos por el odontólogo, sobre todo a la hora de llevar a cabo un procedimiento quirúrgico, para saber cuál debe ser el correcto manejo odontológico para evitar posibles complicaciones, no solo desde el punto de vista del sangrado local, sino, lo que es más importante, para evitar complicaciones sistémicas (como trombosis del stent o aparición de un nuevo evento tromboembólico), que podrían poner en riesgo la vida del paciente 2
El propósito de esta revisión narrativa es, en primer lugar, recordar la fisiología plaquetaria y los mecanismos de formación del trombo plaquetario; en segundo lugar, profundizar en los mecanismos de acción de los diferentes fármacos antiagregantes plaquetarios; y, en tercer lugar, ya que no existen guías clínicas al respecto, realizar un abordaje crítico de las pautas existentes para el correcto manejo odontológico de los mismos, de cara a la realización de un procedimiento quirúrgico en la cavidad oral o incluso una simple extracción dentaria, con suficientes garantías de éxito.
Fisiología de la plaqueta
La plaqueta es uno de los elementos formes de la sangre, junto con los glóbulos rojos y los glóbulos blancos. Normal- mente, en la sangre hay entre 150.000 y 400.000 plaquetas por mL, y el volumen plaquetario medio suele ser de 7-9 micrómetros cúbicos. Las plaquetas proceden de las células madre hematopoyéticas de la médula ósea, concretamente de la estirpe mieloide y tienen una vida media de 7 a 10 días. En su interior, se encuentran los gránulos alfa y gránulos densos, donde se acumulan moléculas de especial relevancia en la fisiología plaquetaria 3
Las plaquetas juegan un papel primordial en la hemostasia, ya que inician la reparación de las lesiones vasculares, formando el tapón plaquetario, pero también promueven la coagulación de la sangre, a través de la activación de la trombina liberada desde las propias plaquetas y del calcio liberado de los gránulos densos que es necesario para la formación de la fibrina 3.
En la fisiología plaquetaria intervienen varias enzimas, como la ciclooxigenasa (COX), que transforma el ácido araquidónico (AA) procedente de los fosfolípidos de la membrana, en prostaglandinas (PG), que son el tromboxa- no A2 (TXA2), vasoconstrictor y proagregante plaquetario y la prostaciclina (PGI2), que es vasodilatadora y antiagre- gante y se origina en el endotelio vascular3. Otras enzimas de las plaquetas son: la fosfolipasa A2, que libera el AA de los fosfolípidos de la membrana y la fosfodiesterasa, que hidroliza el AMPc.
Las plaquetas tienen en su membrana receptores que son glicoproteínas (GP) y están inactivos en condiciones nor- males. Los más relevantes son GP Ia y GP VI que se unen al colágeno, GP Ib que se une al factor von Willebrand (FVW) y GP IIb/IIIa, que se une a varias proteínas, pero la más importante es el fibrinógeno. Estos receptores parti- cipan en los fenómenos plaquetarios de adhesión (unión de la plaqueta al vaso lesionado), activación (cambio de morfología de la plaqueta que provoca la secreción de los gránulos) y agregación (unión entre varias plaquetas)3.
Mecanismo de formación del trombo plaquetario
Las plaquetas circulan en el torrente sanguíneo en forma inactiva. Pero cuando se produce una lesión en un vaso, se expone el colágeno subendotelial, que es el estímulo para reclutar las plaquetas que van a formar el tapón pla- quetario. Hay que recordar que las plaquetas no se ad- hieren al endotelio intacto, pero sí se pueden adherir a un cuerpo extraño dentro del torrente sanguíneo (como puede ser, por ejemplo, un stent coronario o una prótesis valvular cardíaca)3.
Adhesión: Cuando se lesiona un vaso, las plaquetas circulantes enlentecen su velocidad sobre la zona dañada, en contra del flujo sanguíneo que las empuja, gracias a que el receptor plaquetario GP Ib se une al factor von Willebrand (FVW) de la matriz bajo el endotelio. Después, el colágeno subendotelial establece una unión más estable uniéndose al GP Ia y GP VI plaquetarios3.
Activación: Tras la adhesión, se produce la activación de la plaqueta, apareciendo en el exterior los receptores que estaban inactivos. Estos activan moléculas intracelulares, que provocan un cambio en la morfología plaquetaria, con emisión de pseudópodos y liberación de ciertas sustancias que promueven la agregación plaquetaria, perpetuando el proceso. Estas moléculas, conocidas como agonistas plaquetarios son: el TXA2, el ADP y la trombina. De todos ellos, el ADP es el más potente para reclutar plaquetas y propagar el trombo arterial, por lo que se le considera un amplificador de la activación plaquetaria.
Las plaquetas presentan en su superficie tres receptores para el ADP: P2Y1, P2Y12 y P2X. Cada uno induce distintas vías de señalización plaquetarias, pero el P2Y12 es el más importante, ya que favorece la liberación del contenido de los gránulos, el aumento del calcio intracelular, la generación del TXA2 y la activación del receptor GP IIb-IIIa, que es clave en la agregación plaquetaria. En consecuencia, el bloqueo del receptor P2Y12 plaquetario es crucial para inhibir la activación y la agregación plaquetarias e impedir, por tanto, la formación del trombo plaquetario. Por todo ello, durante los últimos años se han desarrollado nuevos fármacos ca- paces de bloquear este receptor1.
Liberación: Tras la activación, se produce la liberación de las moléculas almacenadas en los gránulos de las plaquetas. Las plaquetas activadas pueden liberar hasta 300 pro- teínas diferentes. De los gránulos alfa, se liberan proteí- nas homólogas a las del plasma (fibrinógeno, fibronectina, factor XIII, FVW) y proteínas específicas de las plaquetas (Factor plaquetario 4-FP4, tromboglobulina, P-selectina, PDGF (factor de crecimiento derivado de las plaquetas) y trombospondina). De los gránulos densos se libera ADP, ATP, calcio y serotonina (5-hidroxitriptamina o 5HT)3.
Agregación: Una vez atrapadas las plaquetas en la zona dañada, se produce el reclutamiento de nuevas plaquetas desde la circulación sanguínea, lo que se conoce como agregación plaquetaria. La activación del receptor GP IIb/ IIIa es la vía final que conduce a la agregación plaqueta- ria. Una vez activado, se une a sus ligandos, que tienen la secuencia de aminoácidos RGD (Arg-Gly-Asp o argini- na-glicina-aspártico), como el fibrinógeno, pero también el FVW, la fibronectina y la vitronectina. Este receptor es específico de las plaquetas y se une de forma bivalente al fibrinógeno, formando puentes de unión entre dos plaquetas3.
Respecto a los mecanismos que regulan la agregación
plaquetaria, están los favorecedores y los inhibidores. Así, favorecen la agregación plaquetaria el ADP, la trombina, el
colágeno, la adrenalina y el TXA2. Mientras que el AMPc,
GMPc y la PGI2 la inhiben, así como el óxido nítrico (NO), que además de ser antiagregante plaquetario, es considerado el mayor vasodilatador del organismo3
Fármacos antiagregantes plaquetarios (AAP)
Los antiagregantes plaquetarios (AAP) son fármacos que
inhiben la agregación plaquetaria, actuando como antitrombóticos. Suelen actuar de forma irreversible y no se puede monitorizar su función, pero se suele considerar que su efecto dura lo que dura la vida media de la plaqueta, es decir, entre 7 y 10 días1.
Las principales indicaciones de estos fármacos incluyen los síndromes coronarios agudos
(SCA) (que engloban el infarto agudo de miocardio-IAM y
la angina inestable), la enfermedad coronaria estable, la
enfermedad cerebrovascular y la enfermedad arterial periférica, pero también se utilizan después de los tratamientos quirúrgicos que se realizan tras la aparición de estos cuadros, como la intervención coronaria percutánea (ICP) o la cirugía de revascularización, y en la prevención de la recurrencia de los mismos, es decir, en la profilaxis secundaria de la enfermedad aterosclerótica 1 .
Los AAP son fármacos cuyo mecanismo de acción se basa
en inhibir las enzimas plaquetarias, como la COX (ácido
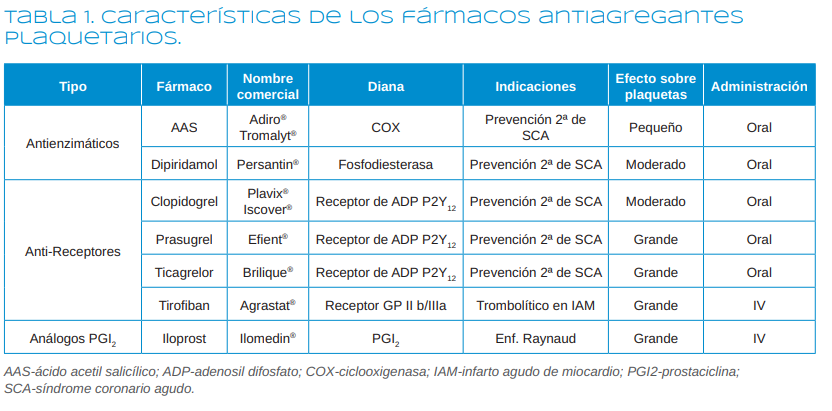
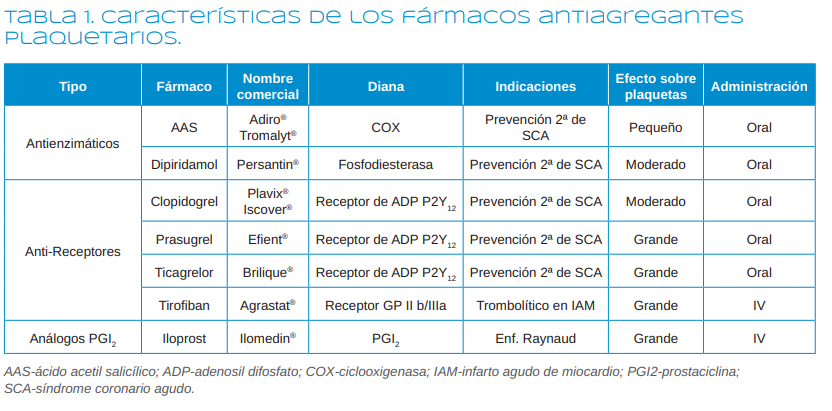
acetilsalicílico) o la fosfodiesterasa (dipiridamol), en bloquear el receptor P2Y12 plaquetario (como las tienopiridinas) o el receptor GP IIb/III a (como el tirofiban) o en actuar como análogos de moléculas que inhiben la agregación plaquetaria (como el iloprost) (Tabla 1).
Los AAP se pueden clasificar según su mecanismo de acción en4-7:
1. Antienzimáticos
1.1. Inhibidores de la ciclooxigenasa (COX)
1.1.1. Ácido acetil salicílico-AAS (Aspirina®, Adiro®, Tromalyt®)
1.1.2. Triflusal (Disgren®)
1.2. Inhibidores de la fosfodiesterasa
1.2.1. Dipiridamol (Persantin®)
1.2.2. Cilostazol
1.2.3. Pentoxifilina
2. Inhibidores de los receptores
2.1. De ADP (P2Y12): Ticlopidina, Clopidogrel, Prasugrel, Ticagrelor
2.2. De GP IIb/IIIa: Abcximab, Tirofiban, Eptifibatide
2.3. De trombina (PAR1): Vorapaxar
3. Análogos de la prostaciclina
3.1. Iloprost (Ilomedin®)
1. Antienzimáticos
1.1. Inhibidores de la COX
1.1.1. Ácido acetil salicílico (Adiro® y Tromalyt®)
El ácido acetil salicílico (AAS) es el antiagregante por excelencia. Es un inhibidor irreversible de las ciclooxigenasas COX-1 y COX-2
de la plaqueta y, por tanto, inhibe la síntesis
del TXA2 plaquetario y de la PGI2 del endotelio vascular, pero sobre todo del primero.
Además, dosis pequeñas parecen afectar solo al TXA2. Asimismo, las plaquetas, al no
tener núcleo, no tienen capacidad de volver a sintetizar la COX, a diferencia de las células endoteliales, por lo que la inhibición del TXA2 dura lo que dura la vida media de la plaqueta, es decir, entre 7 y 10 días.
La inhibición del TXA2 solo suprime uno de los mecanismos de la agregación, pero no afecta a la agregación inducida por ADP.
Sin embargo, otro efecto del AAS en las plaquetas es que disminuye la secreción de los gránulos densos, es decir, disminuye la liberación de sustancias proagregantes durante
la activación plaquetaria.
Esto explicaría por qué sus efectos sobre las plaquetas son mayores de lo que cabría esperar de la simple inhibición plaquetaria dependiente de un agonista relativamente débil como es el TXA21.
El AAS es la terapia antitrombótica básica, usada como tratamiento antiagregante único en la prevención secundaria de la enfermedad aterosclerótica8.
1.1.2. Triflusal (Disgren®)
El triflusal es un análogo del AAS, que inhibe de forma selectiva la COX plaquetaria, pero no afecta a las células endoteliales. El triflusal tiene menos efectos secundarios que el
AAS, por lo que se indica en pacientes con resistencia al AAS y en pacientes geriátricos.
1.2. Inhibidores de las fosfodiesterasas
1.2.1. Dipiridamol (Persantin®)
El dipiridamol es un inhibidor de la fosfodiesterasa, que aumenta los niveles de AMPc intracelular, inhibiendo la agregación; además es vasodilatador. No presenta ventajas respecto al AAS, pero
puede asociarse a fármacos anticoagulantes y
darse a pacientes portadores de prótesis valvulares cardíacas con intolerancia al AAS.
1.2.2. Cilostazol
Incrementa los niveles de AMPc intracelular y es
vasodilatador.
1.2.3. Pentoxifilina
La pentoxifilina es un vasodilatador inhibidor de la
fosfodiesterasa, que actualmente se emplea en la prevención de la osteonecrosis de los maxilares.
2. Inhibidores de los receptores plaquetarios
2.1. Inhibidores del receptor de ADP P2Y12
2.1.1. Inhibidores irreversibles: Tienopiridinas
2.1.1.1. De 1ª generación: Ticlopidina (Tiklid®)
La ticlopidina es un derivado tienopiridínico, que se comporta como un profármaco, es decir, se metaboliza en el hígado dando lugar a un metabolito activo, que antagoniza la agregación inducida por ADP. Fue el primer
inhibidor del receptor P2Y12, pero la relativa frecuencia de reacciones adversas, como la
diarrea y, sobre todo, la neutropenia (en un 0,8% de los casos), ha hecho que su uso sea
cada vez más reducido.
2.1.1.2. De 2ª generación: Clopidogrel (Plavix®,
Iscover®)
Es un profármaco, que requiere dos reacciones de oxidación en el hígado para transformarse en el metabolito activo, que
inhibe al receptor P2Y12. Sin embargo, se ha descrito una gran variabilidad individual en la respuesta antiagregante inducida por clopidogrel. Suele emplearse a una dosis de 75 mg al día, siendo más potente que 100
mg de AAS.
Se puede administrar juntamente con el AAS, para el tratamiento del SCA tras la colocación un stent coronario o posterior a la
cirugía de revascularización percutánea, lo que constituye la llamada “terapia antiagregante dual” o “doble antiagregación plaquetaria” (DAP).
2.1.1.3. De 3ª generación: Prasugrel (Efient®)
El prasugrel es otro profármaco que inhibe el receptor P2Y12, y es más potente, más rápido y presenta menor variabilidad en la respuesta antiagregante que el clopidogrel. Es el único que tiene beneficios en diabéticos.
2.1.2. Inhibidores reversibles
2.1.2.1. Ticagrelor (Brilique®)
El ticagrelor es un antagonista del receptor P2Y12 de efecto reversible. Es más rápido y potente que el clopidogrel. Además, tiene efectos extraplaquetarios que resultan beneficiosos desde un punto de vista cardiovascular.
2.1.2.2. Cangrelor
Recientemente se han diseñado nuevos antagonistas cangrelor y elinogrel, aún más potentes. Estos nuevos antiagregantes consiguen una mayor eficacia antitrombótica, pero también implican un mayor riesgo de
sangrado.
2.2. Inhibidor del receptor GP IIb/IIIa
2.2.1. Abcximab, Tirofiban, Eptifibatide
Son antiagregantes de uso hospitalario que se
emplean de forma IV, bloqueando la unión del fibrinógeno y el FVW a las glicoproteínas de la
superficie plaquetaria (mediada por el receptor GP II b/III a).
Se emplean como fármacos trombolíticos de urgencia en el tratamiento del IAM. Cuanto antes se instaure la terapia con inhibidores del GP IIb/III a, más favorable será el pronóstico del IAM.
2.3. Antagonista del PAR1 (receptor activador de proteasa 12)
2.3.1. Vorapaxar (Zontivity ®)
Inhibe la agregación mediada por la trombina, pues es antagonista del receptor de trombina PAR1. Aceptado por la FDA, pero no por la EMA.
3. Análogos de la prostaciclina
3.1. Iloprost (Ilomedin®)
El iloprost es un análogo de la prostaciclina, que aumenta el AMPc intraplaquetario y además es vasodilatador. Se usa en arteriopatías periféricas, tromboangeítis obliterante y enfermedad de Raynaud.
El Grupo de Trabajo de Trombosis Cardiovascular de la
Sociedad Española de Cardiología8, coordinado por la Sociedad Española de Cardiología (SEC) y formado por representantes de la mayoría de las sociedades médicas españolas, considera que los procedimientos quirúrgicos odontológicos son de bajo riesgo hemorrágico, ya que la hemostasia se puede conseguir adecuadamente, una posible hemorragia no supone un riesgo vital para el paciente ni compromete el resultado de la cirugía y no suelen requerir transfusión.
Mientras que algunos procedimientos de cirugía maxilofacial pueden ser de riesgo medio o alto; riesgo medio sería cuando la hemorragia puede acabar en transfusión o reintervención (como exéresis de tumores, resección radical de maxilar o mandíbula o reducción de fracturas óseas complicadas); y el riesgo alto existiría en
aquellas intervenciones en las que la hemorragia perioperatoria puede comprometer la vida del paciente o el resultado de la cirugía, como en la cirugía de Lefort I, II o III.
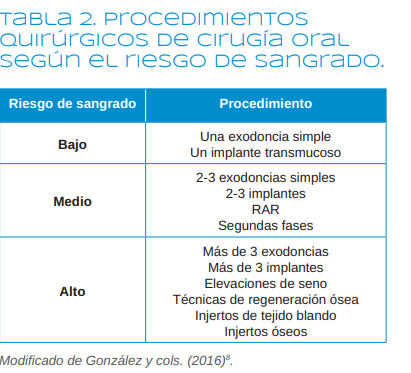
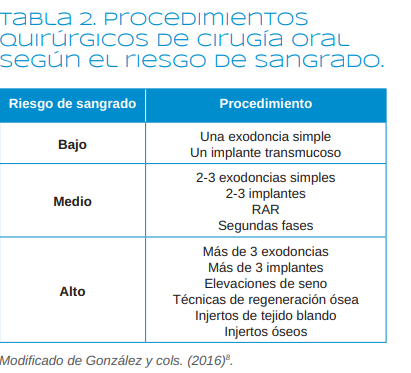
Sin embargo, los autores de este trabajo consideramos que el riesgo hemorrágico de los procedimientos odontológicos debe ser estratificado de otra forma. Por ello, hemos clasificado el riesgo de sangrado siguiendo a González y
cols9 en: bajo riesgo hemorrágico, si se va a hacer una exodoncia simple o un implante transmucoso; riesgo medio, si se van a realizar menos de 3 exodoncias simples,
menos de 3 implantes, segundas fases o raspados y alisados radiculares (RAR); y riesgo elevado si se van a realizar procedimientos regenerativos, injertos tanto de tejidos blandos como duros, elevaciones de seno, extracciones
de dientes retenidos, más de 3 implantes o más de 3 extracciones (Tabla 2).
La tasa de incidencia de hemorragias postextracción en
pacientes en tratamiento con AAP varía en la literatura del
0 al 17,4%10-13.
Sin embargo, hay que tener en cuenta que en estos pacientes el riesgo trombótico es más importante que el riesgo de sangrado7. La interrupción de la terapia antiagregante puede desencadenar eventos tromboembólicos con serias consecuencias7.
La trombosis de un stent es un evento raro, pero potencialmente catastrófico, pudiendo desencadenar un SCA o incluso la muerte en un 25-45% de los casos14, sobre todo en los primeros 6 meses de su colocación8.
Para estratificar el riesgo trombótico, lo más importante es
el tiempo transcurrido desde el episodio isquémico, pero
también hay que considerar el tipo de stent implantado y la forma de presentación del episodio isquémico. Hay que
destacar la falta de ensayos clínicos8.
Los pacientes portadores de un stent tienen mayor riesgo de complicaciones tromboembólicas que los que padecen una enfermedad coronaria estable7,14, sobre todo cuando se ha insertado un stent liberador de fármacos o stent farmacoactivo (SFA), máxime los de primera generación, que se asocian con más posibilidad de trombosis que
los de segunda generación, que han mejorado su perfil de seguridad8.
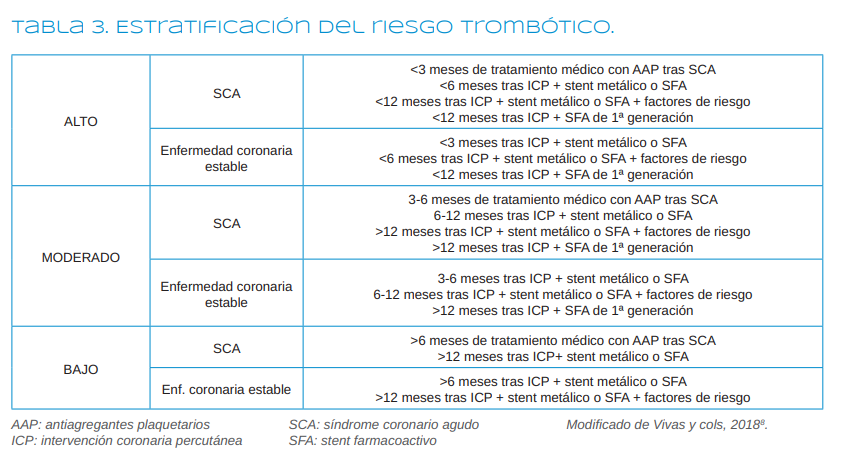
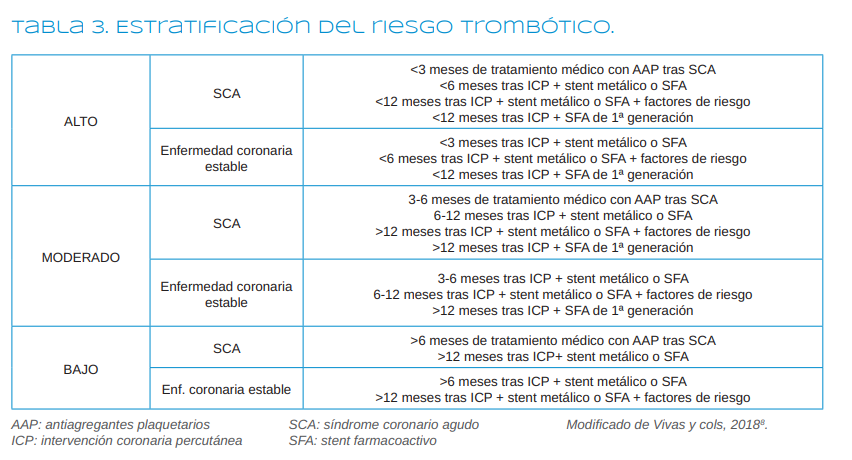
Según Vivas y cols.8, (2018), se habla de un riesgo trombótico alto cuando ha pasado menos de 3 meses del SCA que solo está bajo tratamiento médico (sobre todo durante el primer mes) o menos de 6 meses de la implantación de un SFA de segunda generación o menos de 12 meses del SFA de primera generación.
El riesgo trombótico será moderado cuando ha pasado entre 3 y 6 meses del SCA bajo tratamiento médico, entre 6
y 12 meses tras colocación del SFA de segunda generación o más de un año de SFA de primera generación.
El riesgo trombótico se considera bajo si ha pasado más de 6 meses del SCA bajo tratamiento médico o más de un año desde la colocación del SFA de segunda generación8 (Tabla 3).
En general, sin tener que consultar al cardiólogo por el tipo de stent, se puede resumir el riesgo trombótico como: riesgo alto si han pasado menos de 6 meses de la implantación de cualquier tipo de stent; riesgo medio, si han pasado entre 6 y 12 meses de la inserción de cualquier tipo de stent; y riesgo bajo, si han pasado más de 12 meses de la colocación de cualquier stent o no tiene stent.
En general, los portadores de uno o varios stent se someten a doble antiagregación plaquetaria (DAP) durante el año siguiente a la cirugía de implantación8, por lo que durante este período de tiempo su riesgo trombótico se considera moderado-alto y su riesgo hemorrágico también. La retirada del AAS produce un efecto rebote en la fisiología plaquetaria, de tal forma que disminuye la fibrinolisis
y aumenta la producción del TXA26.
Cada día que se suspende el AAS o el clopidogrel se produce una regeneración plaquetaria de un 15-20%3, es decir, tras el cese de la terapia antiagregante, la agregación plaquetaria vuelve al nivel basal a los 5 días6.
AAS
Riesgo hemorrágico
Omar y cols.15, en 2015, observaron que la administración de AAS no aumentó el riesgo de sangrado en pacientes a los que se realizó extracción de todos los dientes (full-mouth extraction), recomendando mantener el AAS y hacer uso de medidas hemostáticas locales.
En el estudio de Lu y cols16 (2015), la incidencia de hemorragias en el grupo con AAS fue de 1,2% vs 0,7% en el grupo control, por lo que no aconsejan retirar el fármaco.
Eapen y cols.17, en 2017, diseñaron un estudio prospectivo con 80 pacientes en tratamiento con AAS a dosis bajas a los que se les iba a realizar extracciones dentarias. En un grupo se retiró el AAS y en el otro se mantuvo. En ningún
caso hubo sangrado postoperatorio prolongado y solo en un caso con AAS hubo que realizar medidas hemostáticas
locales. Este grupo preconiza no interrumpir el AAS antes de la extracción dental.
En el estudio prospectivo de Gupta y cols.18, 2018, concluyen que no es necesaria la retirada de AAS previo a las extracciones dentarias, pues la hemorragia local se puede solventar con medidas hemostáticas locales.
Riesgo trombótico e interrupción del AAS
En el metaanálisis de Burger y cols.19, se observó un aumento entre un 2,3% y un 6,1% de los eventos cardiovasculares agudos cuando se retiraba el AAS antes de una
intervención quirúrgica.
En el metaanálisis de Biondi-Zoccai y cols.20, con más de 50.000 pacientes, encontraron que la interrupción del AAS produjo efectos cardiovasculares adversos, por lo que aconsejaban no interrumpir la terapia con AAS.
Según Mahmood y cols.7, el AAS no debe interrumpirse, sobre todo si está indicado en la prevención secundaria del SCA, accidente cerebrovascular o tras cirugía de revascularización 7.
Para los pacientes con antiagregación simple (SAP), se recomienda mantener el AAS, puesto que se ha demostrado que reduce el riesgo isquémico sin aumentar significativamente el riesgo de hemorragia, según el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología 8.
Clopidogrel
Riesgo hemorrágico Omar y cols.15 observaron que la administración de clopidogrel no incrementó el riesgo de sangrado en pacientes a los que se les extrajeron todos los dientes (full-mouth extraction), recomendando mantener el clopidogrel y emplear medidas hemostáticas locales.
Riesgo trombótico e interrupción del clopidogrel
Los portadores de stent tienen mayor riesgo de complicaciones trombóticas, sobre todo los recubiertos de fármacos. En la literatura hay ejemplos donde se reporta que, tras la retirada del clopidogrel, se produce una trombosis del stent14,21,22.
La retirada del clopidogrel es un factor de riesgo para la
trombosis del stent. Cuando el paciente está en tratamiento AAP único con clopidogrel se aconseja no retirarlo 7.
Cuando el riesgo trombótico es alto o moderado, el clopidogrel no debe ser retirado antes de una cirugía dentoalveolar 7. Es preferible diferir la cirugía hasta que el riesgo trombótico sea bajo8.
Cuando han pasado más de 12 meses de la inserción del stent y el riesgo trombótico es bajo, si el procedimiento odontológico entraña un bajo riesgo hemorrágico, como puede ser una exodoncia simple, no hay que retirar el clopidogrel. Pero si el procedimiento quirúrgico es
una cirugía regenerativa, con un alto riesgo hemorrágico, se consultará con el cardiólogo para retirar el clopidogrel 5
días antes de la cirugía y volver a tomar a las 24-48 horas.
DAP
Riesgo hemorrágico
Lillis y cols.23compararon el sangrado tras extracciones
dentarias en pacientes con DAP vs SAP y observaron un
mayor sangrado en DAP. Sin embargo, todos los casos
fueron satisfactoriamente manejados con medidas hemostáticas locales.
En el estudio de Lu y cols16, la incidencia de hemorragias en el grupo DAP fue de 4,4% vs 0,7% en el grupo control, sin embargo, no aconsejan interrumpir este tratamiento antes de las extracciones dentarias.
Napeñas y cols.24, no encontraron diferencias significativas en el sangrado intraoperatorio entre los grupos DAP y SAP, aunque observaron mayor sangrado en el postoperatorio inmediato en el grupo de DAP. Su opinión es que no es necesario interrumpir la terapia antiagregante dual antes
del procedimiento quirúrgico dental.
Olmos-Carrasco en 201810 encontraron un 8,3% de complicaciones hemorrágicas en los primeros 30 minutos tras la extracción dentaria en pacientes con DAP, que se resolvieron con medidas hemostáticas locales.
Nathwani y Martin en 201625 realizaron una revisión de la literatura y en los artículos consultados todos los casos de sangrado bajo DAP fueron resueltos con medidas hemostáticas locales, por lo que no aconsejan interrumpir la pauta antiagregante.
En la revisión sistemática de Ockerman de 201926 encontraron mayor sangrado postoperatorio con DAP que con
SAP, pero todos los casos se solventaron con medidas hemostáticas locales y los autores no recomiendan la retirada de ningún AAP antes de las exodoncias.
Sánchez-Palomino y cols.12 consideran que una gasa impregnada en ácido tranexámico (Amchafibrin®) durante 30 minutos es aconsejable para evitar el sangrado postoperatorio en pacientes con SAP y DAP.
Mahmood y cols. en 2020 7 comentan que no existe ningún artículo de hemorragia incontrolada tras la cirugía dental en pacientes bajo DAP y concluyen que no hay indicación de interrumpir la DAP previamente a un procedimiento quirúrgico de la cavidad oral.
Riesgo trombótico e interrupción de DAP.
En el artículo publicado conjuntamente por la Asociación
Dental Americana, la Asociación Americana del Corazón, el Colegio Americano de Cardiología, la Sociedad de Angiografía e Intervención Cardiovascular y el Colegio Americano de Cirujanos27 se destacó la importancia de continuar con la DAP en pacientes con stent coronarios. La interrupción del tratamiento dual con aspirina y clopidogrel
en pacientes con stents se asocia con un riesgo entre 5 y
10 veces mayor de sufrir un infarto de miocardio e incluso
de mortalidad. Este riesgo es inversamente proporcional al
tiempo transcurrido desde la inserción del stent.
El riesgo de trombosis es mayor que el riesgo de sangrado, por lo que la retirada del AAS o del clopidogrel debe ser evitada27.
En los pacientes bajo DAP las cirugías dentales deben ser
pospuestas hasta que dejen esta pauta. Solo podrán ser
sometidos a cirugía si su vida depende de ello y sin interrumpir la DAP7. En la revisión sistemática de Childers y cols.28 reafirman la necesidad de realizar una evaluación del riesgo-beneficio antes de someter a estos pacientes a una cirugía dental.
Según el Grupo de Trabajo de Trombosis Cardiovascular
de la Sociedad Española de Cardiología8, que busca un consenso para homogeneizar protocolos, la primera consideración con los pacientes bajo DAP es valorar la necesidad de intervención electiva mientras el riesgo trombótico sea moderado-alto; si la intervención puede demorarse, es mejor posponerla hasta que el riesgo trombótico del paciente se considere bajo.
Cuando el riesgo trombótico es bajo, es decir, han pasado
más de 12 meses tras la implantación de cualquier stent,
pero el cardiólogo ha preferido mantener la DAP más allá
del primer año, y se van a someter a procedimientos quirúrgicos odontológicos menores, de riesgo hemorrágico
bajo, como una extracción simple, se debe mantener siempre el AAS y el clopidogrel. Si el riesgo trombótico es bajo
y el riesgo hemorrágico es moderado-alto, por ejemplo, en
un procedimiento de cirugía regenerativa, habrá que consultar con el cardiólogo la posible retirada del clopidogrel 5 días antes de la cirugía.
Durante muchos años, los odontólogos hemos sobreestimado el riesgo de sangrado local cuando se realizaban exodoncias o se ponían implantes en pacientes que tomaban antiagregantes y, en cambio, hemos subestimado el riesgo de trombosis, promoviendo la retirada del fármaco entre 5 y 7 días antes del acto quirúrgico. Sin embargo, las recomendaciones actuales, van en sentido contrario, ya que se ha visto que cuando se retiran los antiagregantes, se pueden producir nuevos eventos cardiovasculares2,6,7,27.
Respecto al riesgo trombótico, sólo se podrán realizar procedimientos quirúrgicos cuando sea bajo, es decir, cuando haya pasado más de un año de la colocación del stent8.
Si no ha pasado más de un año, es preferible demorar la
intervención quirúrgica dental6,8.
Hay que considerar que, actualmente, la medicación antiagregante única no debe ser retirada antes de realizar una exodoncia o un procedimiento quirúrgico en la cavidad oral y, si se modifica, debe ser lo menos posible y previa consulta con el cardiólogo 17,18,23.
Cuando un paciente está en tratamiento con AAS a dosis
bajas (100-300 mg/ día) no se retira6,7,19.
Cuando un paciente está tomando exclusivamente clopidogrel (75 mg) y hay que realizar extracciones dentarias o un procedimiento quirúrgico dental, no se retira. Solo si el riesgo trombótico es bajo y se precisan procedimientos de cirugía regenerativa se podrá retirar el fármaco durante 5 días, previa consulta con el cardiólogo8,15.
Si el paciente está recibiendo terapia antiagregante dual
con AAS más clopidogrel, es porque le han colocado uno o más stent en el último año, por lo que tendrá un riesgo trombótico moderado- alto y no conviene retirar ninguno de los fármacos previamente a una exodoncia o a un procedimiento quirúrgico de cualquier índole 26-30.
Es preferible demorar la intervención quirúrgica 6,8.
Si el paciente tiene un riesgo trombótico bajo y se prevé un
riesgo hemorrágico bajo, se debe mantener la SAP, tanto con AAS como con clopidogrel. Si el paciente siguiera bajo DAP a pesar de haber pasado más de un año de la colocación del stent, se debe consultar con el cardiólogo, conocedor del estado hemodinámico y del tipo de stent que lleva el paciente, para poder retirar exclusivamente el clopidogrel 5 días antes del procedimiento quirúrgico dental.
El AAS se mantendrá siempre.
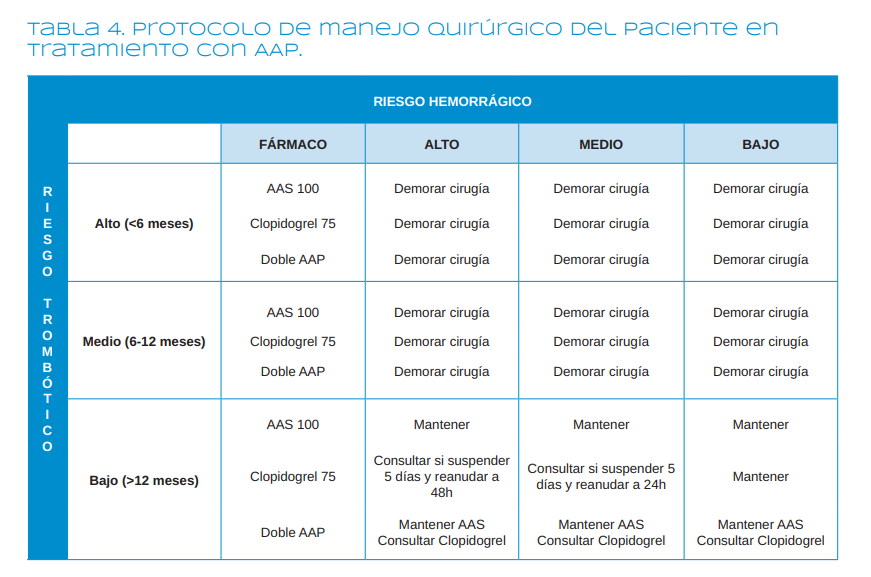
Hay que individualizar cada caso, pero en general 6-13,15-20,23-31
(Tabla 4):
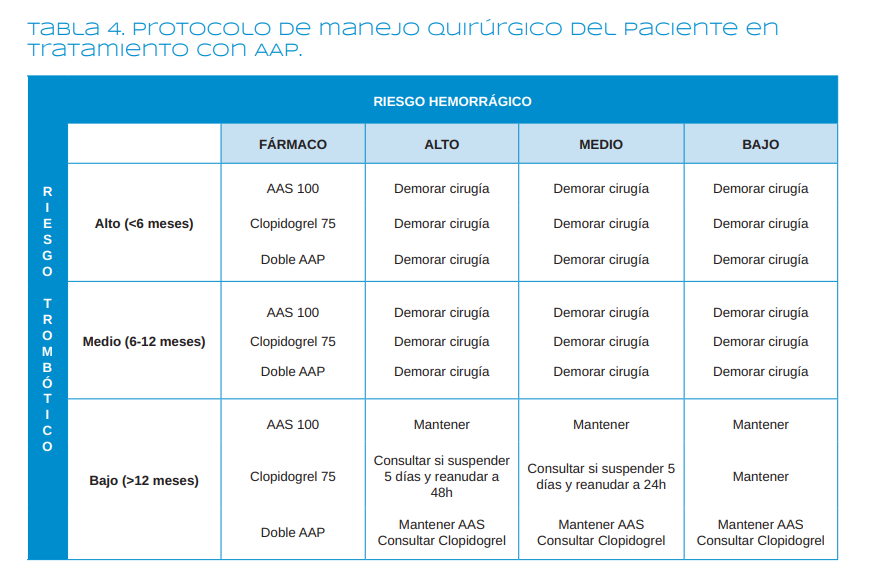
- Cuando el paciente está en tratamiento con AAS 100-300 mg se mantiene siempre.
- Cuando el paciente está tomando clopidogrel a dosis bajas (75 mg/ día), no se retira.
- Si el paciente está en tratamiento con otro AAP más potente que el AAS o clopidogrel (ticagrelor o prasugrel), se consultará con el cardiólogo.
- Cuando el riesgo trombótico es alto (por ejemplo, un paciente con un stent que lleva colocado menos de 6 meses) y el paciente está sometido a DAP, no puede retirarse ninguno de los AAP. Es preferible demorar la intervención8.
- Si el riesgo trombótico es moderado (por ejemplo, un paciente que es portador de un stent que lleva colocado entre 6 y 12 meses), siguiendo a la Sociedad Española de Cardiología, lo ideal es esperar a que el riesgo trombótico sea bajo8
- Si el riesgo trombótico es bajo y el riesgo hemorrágico se prevé bajo, como pueden ser las exodoncias, se mantienen los antiagregantes.
- Si el riesgo trombótico es bajo, pero el riesgo hemorrágico se prevé moderado-alto, como en intervenciones regenerativas, se puede consultar al cardiólogo para suspender el clopidogrel 5 días antes del procedimiento y reanudar a las 48 horas, si el riesgo hemorrágico es alto o a las 24 horas, si el riesgo es moderado8.
- Cuando el paciente está sometido a una terapia antiagregante triple, hay que consultar con el cardiólogo.
- En todos los casos será necesario llevar a cabo medidas hemostáticas locales que, según los autores consultados, son eficaces para prevenir las complicaciones hemorrágicas locales6-19,24-31.
- El ácido tranexámico local es una opción efectiva para reducir el riesgo de sangrado en pacientes que están en tratamiento con antiagregantes plaquetarios12.
- El AAS constituye la terapia antitrombótica básica usada como prevención secundaria de la enfermedad aterotrombótica.
- El AAS es el que menor sangrado origina. La dosis de 100 mg de AAS se mantiene siempre.
- Aunque hay que individualizar cada caso, si el riesgo trombótico es alto o moderado no se pueden retirar los antiagregantes, por ello es mejor esperar a que el riesgo trombótico sea bajo, demorando la cirugía dental.
- Si la terapia antiagregante es con un solo fármaco (SAP), bien AAS 100 mg o clopidogrel 75 mg, se mantiene siempre y se emplearán solo medidas hemostáticas locales. Solo si el riesgo trombótico es bajo y se precisan procedimientos de cirugía regenerativa se podrá retirar el clopidogrel durante 5 días, previa consulta con el cardiólogo.
- Si el paciente está en tratamiento con otro AAP más potente (ticagrelor, prasugrel), se consultará con el cardiólogo.
- Si el riesgo trombótico es bajo, porque han pasado más de 12 meses de la inserción del stent, pero el paciente sigue bajo terapia antiagregante dual, el AAS no se retira. En este caso, si además el riesgo hemorrágico es moderado -alto, se puede consultar con el cardiólogo para la retirada del clopidogrel 5 días antes de la intervención quirúrgica y volver a dar a las 48 horas si el riesgo es alto o a las 24 si el riesgo es moderado.
- Ya va siendo hora de dejar de interrumpir la terapia antiagregante antes de realizar una extracción dental.
Badimon L, Vilahur G. Mecanismos de acción de los diferentes agentes antiplaquetarios. Rev Esp Cardiol 2013;13(B):8-15
Ferrari E, Benhamou M, Cerboni P, Marcel B. Coronary syndromes following aspirin withdrawal: a special risk for late stent thrombosis. J Am Coll Cardiol 2005; 45:456-9
López Farré A, Macaya C. Plaqueta: Fisiología de la activación y la inhibición. Rev Esp Cardiol 2013;13(B):2-7.
Jourdi G, Godier A, Lordkipanidze M, Marquis-Gravel G, Gaussem P. Antiplatelet Therapy for Atherothrombotic Disease in 2022. From Population to Patient-Centered Approaches. Front Cardiovasc Med. 2022 https://doi. org/10.3389/fcvm.2022.805525
Badimon L, Mendieta G, Vilahur G. Diferencias en los mecanismos de acción de los nuevos antiagregantes:
¿cómo actúan? Rev Esp Cardiol Supl 2014;14 (A):3-9
Ganthous AE, Ferneini EM. Aspirin, Plavix, and Other Antiplatelet Medications. What the Oral and Maxillofacial Surgeon Needs to Know. Oral Maxillofacial Surg Clin N Am. 2016 http://dx.doi.org/10.1016/j.coms.2016.06.003
Mahmood H, Siddique I, McKechnie A. Antiplatelet drugs: A review of pharmacology and the perioperative management of patients in oral and maxillofacial surgery. Ann R Coll Surg Engl 2020; 102(1): 9–13.
Vivas D, Roldán I, Ferrandis R, y cols. Manejo perioperatorio y periprocedimiento del tratamiento antitrombótico: documento de consenso de SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH,
SETH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENEC, SEO, SEPA, SERVEI, SECOT y AEU. Rev Esp Cardiol. 2018;71(7):553- 564
González Fernández-Tresguerres F, Alvarez Sirvent A, Torres J, FernándezTresguerres I. Nuevos anticoagulantes orales: repercusión odontológica. Científica Dental 2016;13:35-43.
Olmos-Carrasco O, Pastor-Ramos V, Espinilla-Branco R, y cols. Hemorrhagic complications of dental extractions in 181 patients undergoing double antiplatelet therapy. J Oral Maxillofac Surg 2015;73:203-10
Cardona-Tortajada F, Sainz-Gomez E, Figuerido-Garmendia J, y cols. Dental extractions in patients on antiplatelet therapy. A study conducted by the Oral Health Department of the Navarre Health Service (Spain). Med Oral Patol Oral Cir Bucal 2009;14:e588.
Sanchez-Palomino P, Sanchez-Cobo P, Rodrigues-Archilla A, y cols. Dental extraction in patients receiving dual antiplatelet therapy. Med Oral Patol Oral Cir Bucal 2015;20:e616
Yanamoto S, Hasegawa T, Rokutanda S, y cols. Multicenter Retrospective Study of the Risk Factors of Hemorrhage After Tooth Extraction in Patients Receiving Antiplatelet Therapy. J Oral Maxillofac Surg 2017;75:1338-43.
Iakovou I, Schmidt T, Bonizzoni E y cols. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005;293(2):126–130.
Omar HR, Socias SM, Powless, RA, Sprenker C, Karlnoski R, Mangar D, Camporesi EM. Clopidogrel is not associated with increased bleeding complica¬tions after full-mouth extraction: A retrospective study. J Am Dent Assoc. 2015; 146:303-9.
Lu SY, Tsai CY, Lin LH, Lu SN. Dental extraction without stopping single or dual antiplatelet therapy: Results of a retrospective cohort study. Int J Oral Maxillofac Surg. 2016;45:1293-8.
Eapen BV, Baigi MF, Avinash S. An Assessment of the Incidence of Prolonged Postoperative Bleeding After Dental Extraction Among Patients on Uninterrupted Low Dose Aspirin Therapy and to Evaluate the Need to Stop Such Medication Prior to Dental Extractions. J Maxillofac Oral Surg. 2017;16(1):48-52
Gupta R, Dugal A, Sane VD, Hiwarkar S, Khandelwal S, Iyengar A. Effect of Low-Dose Aspirin on Bleeding Following Exodontia: A Prospective Clinical Study. J Maxillofac Oral Surg. 2018;17(3):350- 355.
Burger W, Chemnitius M, Kneissl GD, Rucker G. Low-dose aspirin for secondary cardiovascular prevention- cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuationreview and meta analysis. J Int Med. 2005;257:399-414.
Biondi-Zoccai GG, Lotrionte M, Agostoni P, y cols. A systematic review and meta-analysis on the hazards of
discontinuing or not adhering to aspirin among 50,279 patients at risk for coronary artery disease. Eur Heart J 2006;27(22):2667–74
Pennacchi M, Stio RE, Lucisano L, Calcagno S, Mancone M, Sardella G. Five years of dual antiplatelet therapy DES thrombosis after clopidogrel withdrawal. Int Heart J 2013;54:234-6.
Artang R, Dieter RS. Analysis of 36 reported cases of late thrombosis in drug-eluting stents placed in coronary arteries. Am J Cardiol 2007; 99(8):1039–43.
Lillis T, Ziakas A, Koskinas K, Tsirlis A, Giannoglou G. Safety of dental extractions during uninterrupted single or dual antiplatelet treatment. Am J Cardiol 2011; 108:964-7.
Napeñas JJ, Oost FC, DeGroot A, y cols. Review of postoperative bleeding risk in dental patients on antiplatelet therapy. Oral Surg Oral Med Oral Pathol Oral Radiol 2013; 115:491–9.
Nathwani S, Martin K. Exodontia in dual antiplatelet therapy: the evidence. Br Dent J 2016;220(5):235-8.
Ockerman A, Bornstein MM, Leung YY, Li SKY, Politis C, Jacobs R. Incidence of bleeding after minor oral surgery in patients on dual antiplatelet therapy: a systematic review and metaanalysis. Int J Oral Maxillofac Surg 2020;49(1):90-8.
Grines CL, Bonow RO, Casey DE Jr, y cols. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: a science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. J Am Dent Assoc 2007;138(5):652-5.
Childers CP, Maggard-Gibbons M, Ulloa JG y cols. Perioperative management of antiplatelet therapy in patients undergoing non-cardiac surgery following coronary stent placement: a systematic review. Syst Rev 2018;7:4.
Park M, Her S, Kwon J. Safety of dental extractions in coronary drug-eluting stenting patients without stopping multiple antiplatelet agents. Clin Cardiol 2012; 35:225-230.
Sáez-Alcaide LM, Sola C, MolineroMourelle P, Paredes-Rodríguez V, Zarrias-Caballero C, HernándezVallejo G. Dental management in patients with antiplatelet therapy: A systematic review. J Clin Exp Dent 2017;9(8):e1044-e1050.
Wahl MJ. Dental surgery and antiplatelet agents: bleed or die. Am J Med 2014; 127:260-7.

González Fernández-Tresguerres, Francisco
Máster en Medicina Oral Universidad Complutense de Madrid (UCM). Máster en Cirugía Bucal e Implantología UCM. Doctor con mención internacional UCM. Colaborador honorífico del Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, UCM
Serrano Zamora, Rebeca
Máster en Medicina Oral UCM, alumna del Máster de Cirugía Bucal e Implantología y de doctorado UCM.
Baca González, Laura
Máster en Implantoprótesis UCM. Máster en Cirugía Bucal e Implantología UCM, alumna de doctorado UCM
Iglesias Velázquez, Óscar
Máster en Medicina Oral UCM. Alumno del Máster en Cirugía Bucal e Implantología UCM. Ayudante del Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, UCM
Xing Gao, Baoluo
Máster en Cirugía Bucal e Implantología UCM, alumno de doctorado UCM.
Fernández-Tresguerres Hernández-Gil, Isabel
Profesor contratado doctor Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, UCM.