Artículo original
Ripollés de Ramón J, Serrano Sánchez V, Colmenero Ruiz C, Vaello Checa I. Estudio clínico piloto de la eficacia de un gel de ácido hialurónico 1% y clorhexidina 0,20% postextracción dental. Cient. Dent. 2020; 17; 3 23-30
Estudio clínico piloto de la eficacia de un gel de ácido hialurónico 1% y clorhexidina 0,20% postextracción dental
Objetivo: El objetivo del presente estudio es comparar la eficacia, en términos de cicatrización oral y dolor postquirúrgico, en un grupo de pacientes tratados con una aplicación oral de ácido hialurónico al 1% junto con clorhexidina al 0,20% frente a pacientes tratados con placebo y un tercer grupo con CHX 0,20% + AH 0,20% + Pantenol.
Metodo: El diseño del estudio es de un estudio analítico, experimental, aleatorizado, ciego, longitudinal prospectivo. Se randomizó una muestra de 45 pacientes, 15 en cada grupo de comparación, en los que se aplicaron postextracción dental unos geles de distinta composición en función del grupo objeto de estudio. En el grupo control se aplicó un gel de ácido hialurónico al 0,20%, clorhexidina al 0,20% y pantenol, en el grupo placebo se aplicó un gel de consistencia similar al anterior pero en ausencia de compuesto y en el grupo experimental se aplicó ácido hialurónico al 1% y clorhexidina al 0,20%. Las variables de eficacia fueron medidas a las 24h., 48h, 72h y 7 días.
Resultados: En relación al dolor postoperatorio no encontramos diferencias estadísticamente significativas en ninguno de los grupos analizados. En relación a la cicatrización el grupo en el que se aplicó ácido hialurónico 1% junto con clorhexidina 0,20% fue el que mejores resultados ofreció desde un punto de vista estadístico en las primeras 24-48h con respecto a los otros dos.
Conclusiones: En vista de los resultados obtenidos parece que las aplicaciones tópicas de ácido hialurónico al 1% junto con la clorhexidina al 0,20% influyen de manera positiva en cuanto a la cicatrización del tejido blando post extracción dental, sin embargo, no parece que tenga efectos beneficiosos en cuanto a los niveles de dolor oral post-intervención.
Objective: The objective of the present study is to compare the efficacy, in terms of oral healing and post-surgical pain, in a group of patients treated with an oral application of 1% hyaluronic acid (HA) together with 0.20% chlorhexidine (CHX), compared to patients treated with placebo and a third group treated with HA 0.20%, CHX 0.20% + Panthenol.
Method: The study design is an analytical, experimental, randomized, blind, prospective longitudinal study. A sample of 45 patients was randomized and divided into 3 comparison groups of 15, with each group receiving a different composition gel after a dental extraction. The control group received a gel of 0.20% hyaluronic acid, 0.20% chlorhexidine; the placebo group was applied a gel of similar consistency to the previous but without active ingredients; and the experimental group received a gel with 1% hyaluronic acid and 0.20% chlorhexidine. Efficacy variables were measured at 24 hours, 48 hours, 72 hours and 7 days.
Results: For post-operative pain, we found no statistically significant differences in any of the groups analysed. For healing, the group receiving 1% hyaluronic acid and 0.20% chlorhexidine had the best results from a statistical point of view in the first 24-48 hours compared to the other two groups.
Conclusions: The results obtained seemed to show that topical applications of 1% hyaluronic acid together with 0.20% chlorhexidine have a positive influence on the healing of soft tissue after dental extraction; however, it does not seem to have any beneficial effects in terms of post-operative oral pain.
Existen infinidad de productos químicos – farmacológicos usados en odontología con distintos fines (antiplaca, remineralizante, blanqueante, desensibilizante…) que son utilizados de diversas formas (colutorios, geles, barnices…). Existe evidencia científica sobre el papel que éstos juegan como coadyuvantes de los diversos tratamientos dentales aplicados en la clínica diaria a fin de mejorar la respuesta terapéutica. Las propiedades que se les exige a estos coadyuvantes terapéuticos de procesos orales son los de especificidad, eficacia, sustantividad y seguridad.
La clorhexidina es el agente antiplaca de elección y probablemente el más eficaz frente a la gingivitis y reducción del biofilm dental, tanto inhibiendo su síntesis como evitando su adhesión al diente. La forma de presentación más habitual en los colutorios de uso oral es el digluconato de clorhexidina. En base a las propiedades anteriormente descritas de este compuesto, su actividad en consulta se encuadra en una esfera preventiva, terapéutica y clínica1-8 .
El ácido hialurónico es un glicosaminoglucano constituido por moléculas de ácido glucurónico y n-acetilglucosamina. Sus dos propiedades más significativas son la de lubricante y amortiguadora debido a la gran concentración de agua capaz de retener que le confieren una extraordinaria elasticidad a los tejidos por un lado, y por otro, un efecto barrera defensivo. Las cualidades clínicas de este producto radican en la mejora de la cicatrización tisular y promotor de la angiogénesis, y reepitelización en base a una estimulación fibroblástica, incrementando la producción de factores de crecimiento y la biosíntesis de diversos tipos de colágeno. Su uso en odontología es mayoritariamente en gel de aplicación directa sobre lesiones en tejidos blandos de cavidad oral y donde los estudios revelan una reducción de la sintomatología dolorosa en especial en las primeras 24h de su aplicación9 . Asimismo, cabe destacar la escasa presencia de estudios de ácido hialurónico aplicado en tejidos blandos de la cavidad oral en relación a otros productos usados de forma habitual en los colutorios de uso oral en el mercado10-14. El objetivo del presente estudio es evaluar los efectos el ácido hialurónico 1% y clorhexidina 0,20% en la cicatrización y dolor postquirúrgico en alveolos postextracción dental.
Este estudio se define analítico, experimental, aleatorizado, ciego, longitudinal y prospectivo, fue realizado acorde a la declaración de Helsinki. Todos los pacientes participantes en este estudio fueron correctamente informados sobre el procedimiento y antes de comenzar a participar en el estudio tuvieron que leer y firmar un consentimiento informado. Asimismo, el Comité ético de investigación clínica del Hospital Clínico San Carlos informó favorablemente sobre la realización del citado estudio con el código 129RX.
La selección de los pacientes fue randomizada según software para aleatorización de muestreo de datos en los siguientes grupos mediante el programa AleatorMetod.xls. Se confeccionaron los siguientes grupos objeto de estudio:
- Grupo Experimental (ácido hialurónico 1% y digluconato clorhexidina 0,20%).
- Grupo Placebo.
- Grupo Control (ácido hialurónico 0,20%, digluconato de clorhexidina 0,20% y pantenol).
En todos los casos, los tubos con el producto que se aplicaron en cada grupo eran blancos y codificados exclusivamente con un número de forma que el operador no podía saber que producto se estaba aplicando; una vez finalizado el estudio y con el cuaderno de recogida de datos, se estableció la relación entre los números de los tubos y el contenido de los mismos en función de los grupos. El estudio fue realizado en todo momento por un único operador a fin de evitar sesgos en las mediciones.
Se incluyeron en el presente estudio los pacientes que acudieron a consulta clínica del Centro de Estudios Superiores de Implantología y Cirugía Oral en Madrid subsidiarios de extracción dental en las posiciones y condiciones requeridas por el estudio. Todos los datos fueron anotados en un cuaderno de recogida de datos, incluyendo los posibles efectos adversos.
El periodo de reclutamiento de los pacientes fue a partir de febrero y agosto de 2018. Los pacientes objeto de nuestro estudio fueron incluidos en base a unos criterios de inclusión que detallamos a continuación:
- Voluntarios a participar en el proyecto de investigación que otorguen tras su explicación el consentimiento informado escrito firmado.
- Edad comprendida entre 18-69 años indiferentemente del sexo.
- Dientes objeto de la extracción grupos: 15-25 y 35- 45 por caries o enfermedad periodontal sin infección activa.
- Personas capaces de comprender y llevar a cabo las instrucciones explicadas por el investigador principal.
- Buen estado de salud ASA I o II y no ingesta de medicamentos.
- Pacientes colaboradores con las citas programadas objeto del estudio.
Asimismo, se explicó el tratamiento a realizar y se entregó un consentimiento informado específico del procedimiento llevado a cabo, en especial de anestesia local y exodoncia; también fueron informados sobre la confidencialidad de los datos médicos y del procedimiento. El paciente tenía la opción de abandonar el estudio en cualquier momento.
Todos los pacientes fueron informados de los riesgos inherentes de la extracción dental que se adjunta en este estudio. Asimismo, se les explicó e informó en relación a la aplicación de los productos antisépticos de clorhexidina y ácido hialurónico que se aplicaron y de las mediciones que llevamos a cabo.
En todos los pacientes se realizó una exodoncia siguiendo los criterios de inclusión y con el mínimo trauma quirúrgico por un único operador. Respecto al grado de cicatrización, evaluamos la distancia medida en mm con un calibre existente en el momento de realizar la extracción. Tomamos como medida el borde medio vestibular lingual o palatino del tejido blando del proceso alveolar del diente extraído y se evaluó de forma basal y con intervalos de 24h, 48h, 72h y a la semana. Una vez realizada la exodoncia, el operador aplicó el producto asignado al paciente de forma ciega en la zona exodonciada, y se le explicó al paciente la necesidad de aplicarla, él mismo, a nivel domiciliario tres veces al día después de las comidas durante siete días. Todos los pacientes recibieron por escrito unas normas básicas de actuación postextracción.
Para el registro del dolor, los pacientes recibieron una hoja de recogida de datos con una escala visual analógica (EVA) (Figura), según severidad: ausente, leve, moderado o intenso.

Cada grupo objeto de estudio estaba formado por 15 pacientes, se reclutó un total de 45 pacientes. No se realizó una determinación del tamaño de la muestra, sino que, de forma similar a otros estudios de investigación publicados en la literatura científica, se realizaron grupos de tamaños similares a fin de evaluar mediante parámetros estadísticos descriptivos la dirección de las variables objeto de nuestro estudio, y a raíz de ahí, valorar el interés en aumentar la muestra.
Con las variables cuantitativas de cicatrización y dolor, se realiza la prueba de bondad de ajuste a la distribución Normal de Saphiro-Wilk. En ambos casos y en todos los momentos del estudio, así como las diferencias calculadas entre los distintos momentos, obtuvimos valores de ajuste a la campana de Gauss, por lo tanto, se resumen con la media y la desviación estándar.
Las diferencias de los valores de cicatrización y el dolor entre los tratamientos en cada momento del estudio se calcularon con el test de ANOVA de un factor. Las diferencias entre los grupos 2 a 2 se realizan con la prueba de comparaciones múltiples de Bonferroni.
La evolución de los valores de cicatrización y dolor en el tiempo, se analizan con un modelo lineal general de medidas repetidas (MLG de medidas repetidas), así como las diferencias en la evolución entre los distintos tratamientos.
Estos mismos análisis se calculan con variables resultantes de la diferencia (delta) en cada paciente y entre los distintos momentos de la medición de los valores de cicatrización y dolor (Δ=Valor inicial-Valor final). Por último se calcula la diferencia de estos valores en cada momento en porcentaje sobre el momento primero o ratio de descenso (Ratio descenso= (Valor inicial-Valor final)/Valor inicial x 100), estudiando la evolución de estas variables también mediante MLG de medidas repetidas, así como las diferencias en la evolución entre los grupos.
Los valores de diferencia (Δ), así como la ratio, se resumen con la media y el error estándar en cada uno de los casos, calculando los intervalos de confianza al 95% de las medias.
Se considera un nivel de seguridad del 95%, lo que nos lleva a considerar un nivel de significación estadísticas con valores p≤0.05.
Todos los análisis se realizaron con el paquete estadístico SPSS versión 24.0 (IBM Corp. Released 2016. IBM SPSS Statistics for Windows, Version 24.0. Armonk, NY: IBM Corp.)
Análisis cicatrización por grupos de tratamiento (Placebo, Control y Experimental)
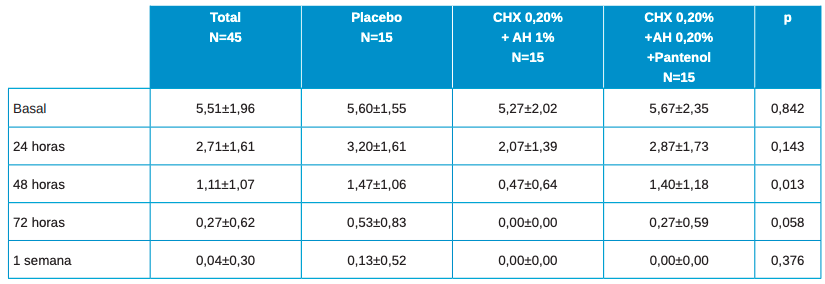
En la Tabla 1 se muestran los datos descriptivos principales de los pacientes, en cada momento del estudio, en el total y por grupo de tratamiento.
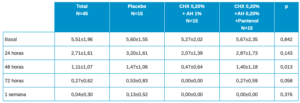
Los valores basales son algo más bajos en el grupo CHX 0,20% + AH 1%, y un poco más altos en los otros dos, si bien estas diferencias no son estadísticamente significativas. Los resultados muestran en las posteriores visitas valores algo más elevados siempre en el grupo placebo y más bajos en los otros grupos de estudio, si bien estas diferencias solo son estadísticamente significativas a las 48h.
La evolución en el global es estadísticamente significativa con p≤0.001. Las diferencias en la evolución entre los 3 grupos de tratamiento, tiene un valor de significación estadística p=0.380, no llegando a la significación estadística en ninguna de las comparaciones entre grupos 2 a 2.
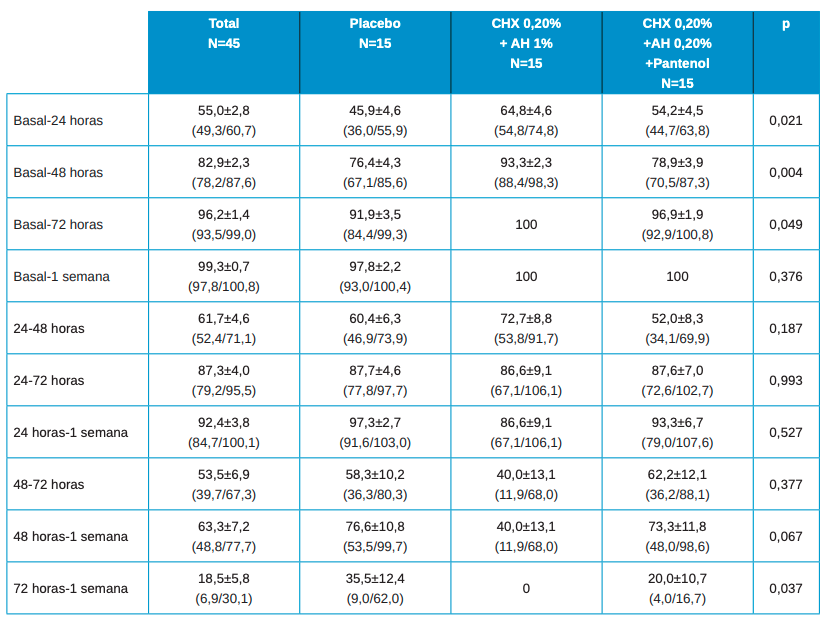
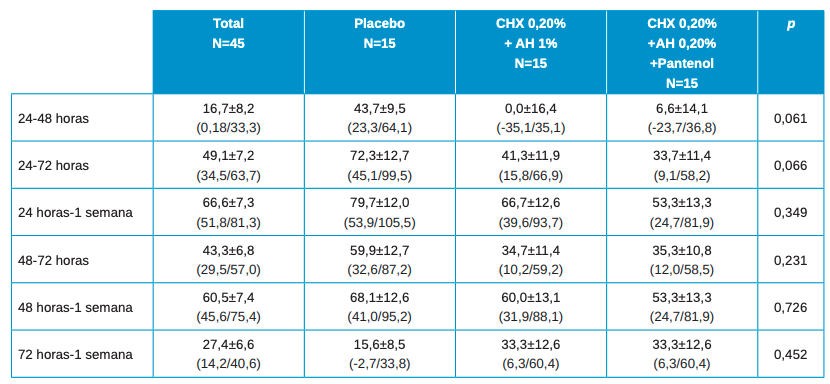
Los valores para la ratio de descenso de estas variables de cicatrización se muestran en la Tabla 2 con los valores de media±SE (error estándar) y entre paréntesis los intervalos de confianza de la media. Se encontraron diferencias estadísticamente significativas en las diferencias entre los grupos cuando se calcula las diferencias para cada paciente entre el valor basal con 24h, 48h y 72h. No se encuentran diferencias estadísticamente significativas en el resto de comparaciones.
En las diferencias estadísticas entre los grupos de tratamiento 2 a 2 a destacar son:
- Basal vs 24h en Placebo vs Test (Clorhexidina 0.20%+ AH 1%) p=0.017.
- Basal vs 48h en Placebo vs Test (Clorhexidina 0.20%+ AH 1%) p=0.006.
- Basal vs 48h en Test (Clorhexidina 0.20%+ AH 1%) vs (Clorhexidina 0.20%+ AH 0.20%+ Pantenol) p=0.022.
- Basal vs 72h en placebo vs Test (Clorhexidina 0.20%+ AH 1%) p=0.047.
- 72h vs 1 semana en Placebo vs Test (Clorhexidina 0.20%+ AH 1%) p=0.033.
Análisis del dolor por grupos de tratamiento
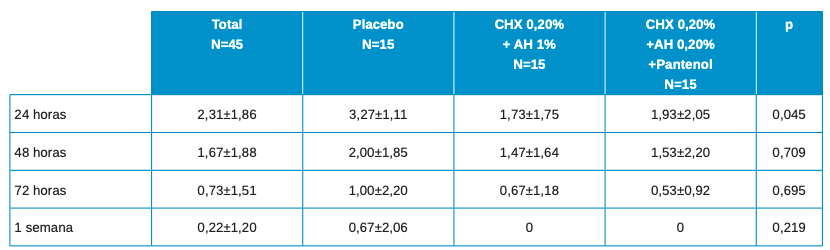
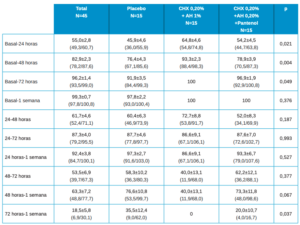
En la Tabla 3 se muestran los datos descriptivos de dolor de los pacientes en el total y por tipo de tratamiento, observando un valor más elevado siempre en placebo, si bien solo encontramos estas diferencias estadísticamente significativas a las 24h.
La evolución en el global es estadísticamente significativa con p≤0,001. Las diferencias en la evolución entre los 3 grupos de tratamiento, tiene un valor de significación estadística p=0,425.
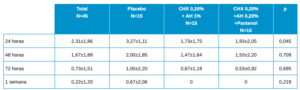
De la misma manera que se ha realizado con cicatrización se calculan los porcentajes de descenso de los valores entre los distintos momentos en el dolor. Estos valores se muestran en la Tabla 4 mediante la media±SE (error estándar) y entre paréntesis los intervalos de confianza de la media. Si bien en ningún caso se encuentran valores de diferencias estadísticamente significativas, sí que hay valores cercanos a la significación estadística en 24-48h y 24-72h.
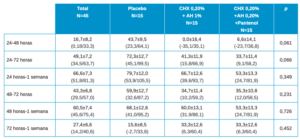
Las diferencias estadísticas entre los grupos de tratamiento 2 a 2 a destacar son:
- 24h vs 48h en Placebo vs Test (Clorhexidina 0,20%+ AH 1%) p=0,068 (tendencia a la significación estadística).
- 24h vs 48h en Control (Clorhexidina 0,20%+ AH 0,20%+ Pantenol) vs Test (Clorhexidina 0,20%+ AH 1%) p=0,068 (tendencia a la significación estadística).
- 24h vs 72h en Control (Clorhexidina 0,20%+ AH 0,20%+ Pantenol) vs Test (Clorhexidina 0,20%+ AH 1%) p=0,064 (tendencia a la significación estadística).
El uso de medicación tópica en el tratamiento de diversos procesos orales es un procedimiento de fácil aplicación.
Probablemente un aspecto destacable de este estudio sobre la aplicación de un gel de ácido hialurónico 1% o bien al 0,20%, o bien usando el placebo es que mejora la percepción de la sintomatología dolorosa de manera bastante homogénea tal y como lo afirman estudios de Nolan y Lee14,15. Podemos constatar, con la bibliografía consultada y con la cual coincidimos en nuestro estudio, que la ausencia de efectos secundarios durante el tiempo de aplicación prescrito evita el abandono del tratamiento14-16. En relación a los resultados obtenidos en relación al grado de cicatrización observamos como la composición de ácido hialurónico al 1% tiene unos resultados más favorables que el grupo placebo o la concentración del grupo hialurónico 0,20%, estos datos no los hemos podido constatar en la literatura dado que no existen estudios en la actualidad similares aplicando el producto en alveolos postextracción sino en su mayoría son aplicados en lesiones ulceradas de la mucosa oral. Probablemente la acción barrera física de la aplicación de los productos en formato gel hizo dificultar la aparición de infecciones tal y como relatan autores como Saxen17 y Porter18. Asimismo, las características de la propia molécula de ácido hialurónico, tales como la absorción de agua y por tanto la hidratación o su función estructural en el sentido de ser composición principal de la matriz extracelular14-17 parece apuntar que una concentración de ácido hialurónico de alto peso molecular al 1% (grupo experimental) pueda ser más beneficiosa en términos de cicatrización. En nuestro estudio las aplicaciones de los productos fueron tres veces al día durante siete días si bien en los estudios consultados17-19 evidencian que la posología en relación a la aplicación del producto puede ser fundamental ya que estos autores encuentran disminución en los beneficios derivados del ácido hialurónico cuando pasan las aplicaciones de ser continuadas a espaciadas en tres veces al día.
En base a los resultados obtenidos podemos poner de manifiesto que la aplicación de un gel de ácido hialurónico al 1% y digluconato de clorhexidina produce un efecto beneficioso en términos de cicatrización en las primeras 24-48h de su aplicación en comparación con los otros grupos.
En relación al dolor postoperatorio encontramos una cierta mejoría de la percepción del dolor por parte del paciente en la observación realizada durante las primeras 24h. Debido a las resultantes de tendencia a la significación estadística en la observación de la cicatrización del alveolo postextracción deberíamos contemplar incrementar el tamaño muestral así como su frecuencia de dosificación para que pudiese obtenerse un resultado más claro en cuanto a su potencia estadística en futuros estudios.
Addy M, Moran J, Newcombe R. A comparison of 0,12% and 0,1% chlorhexidine mouthrinses on the development of plague and gingivitis. Clin Prevent Dent 1991; 13: 26-9.
Addy M, Wade WG, Jenkins S, Gooldfield S. Comparison of two commercially available clorhexidine mouthrinses: I stainning and antimicrobial effects in vitro. Clin Prevent Dent 1989; 11: 10-4.
Banting D, Bosma M, Bollmer B. Clinical effectiveness of a 0,12% chlorhexidine mouthrines over two years. J Dent Res 1989; 68 (Spec. Issue): 1716-8.
Bascones A. Periodoncia Clínica e Implantología Oral. Madrid: Ediciones; Avances Médico-Dentales 2001; 455-71.
Twetman S. Antimicrobials in future caries control? A review with special reference to chlorhexidine treatment. Caries Res 2004;38: 223-229.
Yiu CK, Wei SH. Clinical efficacy of dentifrices in the control of calculus, plaque, and gingivitis. Quintessence Int 1993; 24: 181-188.
Quiryne M, Auontroodt P, Peeters W, Pauwels M, Couche W, Van Steenberghe. Effect of different clorhexidine formulations in mouthrinses on de novo plaque formation. J Clin Periodontol 2001; 1127-36.
Ragno JR, Szkntwik AJ. Evaluation of 0,12% chlorhexidine rinse on the prevention of alveolar osteitis. Oral Surg Oral Med Oral Pathol 1991; 72: 524-26
Rabasseda X. Ácido hialurónico. Papel terapéutico en la gingivitis. Drugs Today 1997; 6: 1-21.
Gontiya G, Galgali SR. Effect of hyaluronan on periodontitis: a clinical and histological study. J Indian Soc Periodontol 2012; 16 (2): 184-192.
Kosaki R1, Watanabe K, Yamaguchi Y. Overproduction of hyaluronan by expression of the hyaluronan synthase Has2 enhances anchorage-independent growth and tumorigenicity. Cancer Res 1999; 59 (5): 1141-1145.
Mesa FL, Gijón J, Cabrera A, López C, O’Valle FJ. Efecto de un gel de ácido hialurónico en la enfermedad periodontal. Estudio clínico e histopatológico. J Periodoncia 2001; 11 (2): 107-116.
Paraskevas S. Randomized controlled clinical trials on agents used for chemical plaque control. Int J Dent Hyg 2005; 3: 162-178.
Nolan A, Ballie C, Badminton J, Rudralingham M, Sey mour RA. The efficacy of topical hyaluronic acid in the management of recurrent aphthous ulceration. J Oral Pathol Med 2006; 35 (8): 461-5.
Lee JH, Jung JY, Bang D. The efficacy of topical 0,2% hyaluronic acid gel on recurrent oral ulcers: comparison between recurrent aphthous ulcers and the oral ulcers of Behçet´s disease. J Eur Acad Dermatol Venereol 2008; 22 (5): 590-5.
Nolan A, Badminton J, Maguire J, Sey mour RA. The efficacy of topical hyaluronic acid in the management of lichen planus. J Oral Pathol Med 2009; 38: 299- 303.
Saxen MA, Ambrosius WT, Rhemtula al – KF, Rusel AL, Eckert GJ. Sustained relief of oral aphthous ulcer pain from topical diclofenaco in hialuronan: a randomized, doublé blind clinical trial. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997; 84 (4): 356-61.
Porter S. Transient benefits for topical hyaluronic acid in recurrent aphthous ulceration. J Oral Pathol Med 2006; 35(8): 461-5.
Cantor JO, Nadkarini PP. Hyaluronan: The Jekyll and Hyde molecule. Inflamm Allergy Drug Targets 2006; 5: 257-60.

Ripollés de Ramón, Jorge
Doctor en Odontología Universidad Complutense de Madrid (UCM). Magíster Cirugía Bucal implantes y periodoncia Universidad de la Coruña (UC).
Serrano Sánchez, Víctor
Graduado en Odontología (UCM). Máster en ciencias Odontológicas (UCM). Experto en Periodoncia (UCM). Magíster en Periodoncia e implantes (en curso UCM).
Colmenero Ruiz, Constantino
Odontólogo UCM. Magister en Cirugía Bucal Hospital Universitario Príncipe de Asturias-Universidad de Alcalá (HUPA-UAH). Magíster Ortodoncia Universidad de Alcalá (UAH).
Vaello Checa, Iris
Graduada en Odontología. Máster en ciencias Odontológicas UCM. Máster en Ortodoncia en curso (UCM).