Científica Dental: abril 2021 (edición exclusiva online)
Artículo original
Gómez Pérez V, Molinos Morera J, Manrique García C, Martín Ares M, Trapote Mateo S, Jiménez García J. Anatomía de la arteria alveolar posterior superior (AAPS): estudio de 32 CBCT. Cient. Dent. 2021; 18; 2; 65-72
Anatomía de la arteria alveolar posterior superior (AAPS): estudio de 32 CBCT
Objetivo: El principal objetivo es proporcionar información desde un punto de vista anatómico, evaluar la prevalencia, el diámetro y la posición de la arteria alveolar posterior superior (AAPS), su relación con la cresta alveolar y el suelo del seno maxilar utilizando imágenes radiográficas.
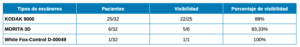
Materiales y métodos: Se ha evaluado un total de treinta y dos imágenes de tomografías computarizadas de haz cónico (CBCT) (cuarenta y un senos maxilares en total) de pacientes parcialmente edéntulos en el tramo maxilar posterior, de los cuales veintitrés fueron mujeres y nueve hombres, que se presentaron en la Clínica Universitaria Odontológica de la Universidad Europea de Madrid. Se utilizaron tres tipos de escáneres CBCT que son el KODAK 9000, MORITA 3D y White Fox-Control D-00049.
Resultados: La arteria alveolar posterior superior tiene un porcentaje de visibilidad de un 43,91%, se localiza a una altura de 15,9 mm de promedio desde la cresta ósea, en los grupos de 1-2 mm y <1 mm de diámetro se obtienen respectivamente 1,2 mm y 0,7 mm de valores promedio, y su posición es en un 21,13% intraósea y en un 22,76% extraósea.
Conclusiones: En nuestro estudio, la AAPS presenta una distancia hasta la cresta alveolar, de mayor a menor altura residual, en primer lugar los segundos premolares, luego los segundos molares, y por último los primeros molares. Es decir, realiza un trayecto en forma de arco, haciendo la concavidad máxima a nivel del primer molar.
Objective: The main objective is to provide information from an anatomical point of view. To evaluate the prevalence, diameter and position of the superior posterior alveolar artery (SPAA), its relationship with the alveolar crest and the floor of the maxillary sinus using radiographic images.
Materials and methods: A total of thirtytwo cone beam computer tomography (CBCT) images (forty-one maxillary sinuses in total) of partially edentulous patients in the posterior maxilla, of which twenty-three are women and nine men, that have been submitted in the University Clinic of the European University of Madrid. Three types of CBCT scanners are used: KODAK 9000, MORITA 3D and White Fox-Control D-00049.
Results: The superior posterior alveolar artery has a visibility percentage of 43.91%, it is located at a height of 15.9 mm on average from the bone crest, in the groups of 1-2 mm and <1 mm in diameter they respectively obtain 1, 2 mm and 0.7 mm of average values and positioned in 21.13% intraosseous and 22.76% extraosseous.
Conclusions: In our study, the PSAA presents a distance to the alveolar crest from higher to lower residual height, first the second premolars, then the second molars, and finally the first molars. In other words, it makes an arc-shaped path, making the maximum concavity at the level of the first molar.
La vascularización del seno maxilar es extensa, variando en las ramificaciones y anastomosis de los vasos sanguíneos, garantizando así una gran cantidad de flujo sanguíneo1 . El suministro sanguíneo al seno maxilar está garantizado por tres arterias principales, siendo ramas de la arteria maxilar: la arteria infraorbitaria (AIO), la arteria esfenopalatina (AEP) y la arteria alveolar posterior superior (AAPS)2 .
Comenzando por su origen vascular, la arteria maxilar es la rama terminal de la arteria carótida externa, siendo la más grande y se divide en cinco ramas en la fosa pterigopalatina3,4. La AIO y las ramas alveolares superior, anterior y posterior de la arteria maxilar irrigan la mucosa del seno maxilar5 .
La arteria maxilar irriga al seno maxilar, donde su presencia fue mencionada por primera vez por Strong y cols. Comienza con una sección retromandibular y tiene origen en el parénquima de la glándula parótida. Luego atraviesa la fosa infratemporal en su porción pterigoidea, para ingresar en la fosa pterigopalatina a través de la sutura pterigomaxilar en su última sección. La AAPS se origina en la fosa pterigopatalina y atraviesa la barrera pterigomaxilar hacia la tuberosidad maxilar6, 7
La arteria maxilar asciende oblicuamente hacia el músculo pterigoideo lateral y desprende tres ramas para el seno maxilar que siguen junto con las del nervio maxilar; la AAPS, la AIO y la AEP4-9.
La AAPS y AIO tienen un tronco común en la fosa pterigopalatina10,11. La mucosa oral del seno maxilar y la membrana de Schneider están vascularizadas por estos dos vasos en un doble círculo arterial12, 13.
La AAPS forma una anastomosis intraósea con la AIO que se encontró en el 100% de los casos en los estudios anatómicos de Traxler y cols.,14. Las ramas dentales suministran el tejido pulpar de los dientes maxilares posteriores a través del agujero apical de los dientes. Las ramas alveolares suministran el periodonto de los dientes maxilares posteriores. Las ramas dental y alveolar también suministran irrigación al seno maxilar15.
La AIO recorre el canal infraorbitario y emerge a través del foramen orbital inferior en la órbita para irrigar el párpado inferior, mejilla, nariz y labio superior5,16. Durante su viaje por el interior del canal infraorbitario emite la arteria alveolar superior anterior que se dirige hacia abajo para suministrar los dientes anteriores y la parte anterior del seno maxilar5 . A partir de la AIO surgen las ramas; arteria alveolar anterior superior (AAAS) y orbitales. Además de la AAPS, la AAAS también emite ramas alveolares y dentales16.
La localización de la arteria en la pared anterior del maxilar superior puede condicionar el tamaño de la antrostomía durante la elevación de seno. Cuando se lleva a cabo la osteotomía mediante abordaje lateral, puede dañarse la AAPS, causando un sangrado severo17.
Estudios basados en la descripción de cadáveres indican solo la presencia de la AAPS en esta región del seno maxilar18. Traxler y cols.14 informaron que el suministro arterial del maxilar se origina a partir de la AAPS y la AIO, con la anastomosis que se forma entre las dos arterias14, 18. Por eso, los autores consideran que la preservación de las arterias de la pared anterior del maxilar es importante para una adecuada vascularización y la cicatrización del injerto óseo particulado19.
En los individuos jóvenes y dentados, el maxilar está densamente vascularizado. Con el aumento de la edad, el número de vasos y sus calibres disminuyen, mientras que la tuberosidad aumenta14,20,21. Las ramas arteriales se encuentran siempre en la pared lateral del seno y pueden variar en ubicación, diámetro y trayecto15.
El recorrido de la rama intraósea de la AAPS y de la AIO en la pared vestibular del seno se divide en dos tipos: tipo I (en forma de “S”), en el 78,1%, y tipo II (en forma de “U”), en el 21,9%22-24. En este segundo tipo, los cambios de dirección ocurren tanto en la región entre el primer y segundo premolar como entre el segundo premolar y el primer molar10,24. Y sobre los diámetros máximos de la AAPS e AIO, se han descrito hasta los 2,7 mm y 3 mm según los autores3, 22-26.
El daño de la AAPS en el acceso al seno maxilar a través de la pared lateral puede producir un sangrado innecesario debido a la rotura de la arteria. Por tanto, el conocimiento detallado de las bases anatómicas, así como una comprensión del suministro arterial del seno maxilar, son importantes para minimizar el riesgo de sangrado en este procedimiento quirúrgico27-30.
El propósito de este estudio es proporcionar información de la AAPS desde un punto de vista anatómico, además de evaluar la prevalencia, diámetro y posición de la misma en pacientes parcialmente edéntulos y su relación con la cresta alveolar y el suelo del seno maxilar. Para ello, se analiza si hay diferencias estadísticamente significativas entre géneros en la longitud a la cresta alveolar y en los diámetros de la AAPS. Se obtiene el porcentaje de visibilidad, altura media a la que se encuentra, diámetro promedio y el porcentaje según la posición intraósea o extraósea de la AAPS obtenida en imágenes tomográficas computarizadas de haz cónico (CBCT).
Se evaluó un total de 32 imágenes CBCT (41 senos maxilares en total) de pacientes parcialmente edéntulos en el tramo posterior, con un rango de edad de 30-85 años, que acudieron a la Clínica Universitaria Odontológica de la Universidad Europea de Madrid, al Departamento de Implantología Oral Avanzada entre 2016 y 2018. Se registró la información de los pacientes que incluyó la edad, el sexo, las razones de la pérdida de dientes y el historial médico.
Los criterios de inclusión fueron: pacientes ASA I y ASA II, con tramo edéntulo en el sector posterior del maxilar, pacientes de la Clínica Odontológica de la Universidad Europea de Madrid. Siendo criterios de exclusión los pacientes con enfermedades sistémicas incapacitantes, pacientes con presencia de dientes en el tramo posterior maxilar, patología sinusal, senos injertados y presencia de implantes dentales.
Los sujetos se dividieron en 2 grupos en función del género:
a) Hombres edéntulos en la región posterior (n = 9).
b) Mujeres edéntulas en la región posterior (n = 23).
Para la identificación de las arterias en la pared lateral del seno maxilar se utilizaron tres tipos de escáneres CBCT que son el KODAK 9000, MORITA 3D y White Fox-Control D-00049.
En primer lugar, se identificaron las arterias en la pared lateral del seno maxilar. Cualquier diferencia entre los investigadores con respecto a la visibilidad de la arteria se resolvió mediante una revisión conjunta de las imágenes, hasta que se alcanzó un consenso.
Se midieron las distancias entre el borde inferior de la AAPS y el reborde alveolar residual y el diámetro de la arteria. También se registró la posición de la arteria en la región posterior, a nivel de segundos premolares, primeros molares y segundos molares.
Las mediciones de los diámetros de la arteria se dividieron en 3 grupos:
a) Grupo 1: menos de 1 mm; b) Grupo 2: entre 1-2 mm; c) Grupo 3: más de 2 mm.
La posición de la arteria se dividió en:
a) Intraósea; b) Extraósea.
Se compararon los parámetros medidos de la AAPS (visibilidad de la arteria, longitud a la cresta alveolar, diámetro y posición intra/extraósea) con otros estudios de la literatura, a través internet en la base de datos MEDLINE, con la siguiente estrategia de búsqueda: (“maxillary sinus” OR “sinus augmentation” OR “sinus lift”) AND (“anatomy” OR “artery” OR “arteries” OR “vascularity” OR “blood supply” OR “vessels”), sin restricción de idioma.
Participaron en este estudio 32 pacientes, con interpretación de 41 senos maxilares. Los porcentajes en función del sexo de los pacientes fueron del 71,875% y 28,125% para mujeres y hombres, respectivamente.
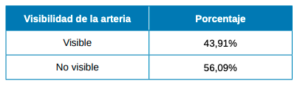
Con respecto a la visibilidad de la AAPS los resultados muestran que es visible en un 43,91% y no es detectada en el 56,09% (Tabla 1).
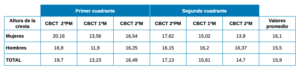
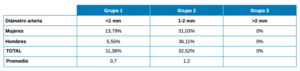
La altura de la AAPS hasta la cresta alveolar tiene un promedio de 15,9 mm (16,1 mm en mujeres y 15,5 mm en hombres) con los valores más altos para la región de segundo premolar y los menores en el primer molar (Tabla 2). El diámetro de la AAPS en el grupo 1 (<1 mm) es de 0,7 mm, en el grupo 2 (1-2 mm) de 1,2 mm y en el grupo 3 (>2 mm) no se encontró ningún caso (Tabla 3). En cuanto a la posición de la AAPS, es intraósea en un 21,13% y extraósea en un 22,76%, siendo mayor el porcentaje de posición intraósea en mujeres que en hombres y al contrario en la posición extraósea (Tabla 4).

Respecto al tipo de escáner utilizado, la visibilidad de la AAPS fue del 88% en el KODAK 9000, de un 83,33% en MORITA 3D y del 100% para White Fox-Control D-00049 (Tabla 5).
La vascularización del seno maxilar es suministrada principalmente por la AAPS, la AIO y la AEP. La mucosa oral, los tejidos periósticos, la membrana sinusal y, especialmente, la pared anterolateral del seno están vascularizados por estas dos primeras arterias en un doble círculo arterial. La rama esfenopalatina de la arteria maxilar suministra a las conchas, los meatos y la parte posteroinferior del tabique nasal, siendo el recipiente principal que suministra la mucosa nasal2, 5, 12, 13.
La elevación del suelo sinusal mediante acceso lateral, utiliza muchos diseños de antrostomía y durante el procedimiento hay que tener en cuenta diferentes criterios, particularmente, el recorrido de las arterias mencionadas, su localización (extraósea, intraósea o intrasinusal), su terminación (la AAPS puede ir libre o anastomosada con la AIO), su curso preciso (largo o corto), su diámetro (grande o pequeño) y si es posible, también saber de dónde se origina28, 31.
Solar y cols.,26 describieron, a través de un esquema, el recorrido de los canales óseos que forman la anastomosis entre la AAPS y la AIO. Informaron que la anastomosis se extiende hasta la mitad de la pared lateral del seno maxilar, aproximadamente a una distancia entre 17 y 23 mm (de media 18,9 mm) del margen alveolar. Esto implica una menor probabilidad de sangrado durante el procedimiento de apertura de la ventana. Rosano y cols.,29 en estudios sobre cadáveres, confirmaban los datos reportados por Solar y cols.,26. En el estudio de Watanabe y cols.,27 también se encontraron resultados similares. La distancia entre la AAPS y la cresta alveolar se encontró de 21,3 a 24,1 mm en la región premolar y de 15,3 a 15,4 mm en la región molar.
Hur y cols.,24 también midieron la longitud entre la anastomosis y la línea cervical de los dientes, siendo 26,9 mm a nivel de los primeros premolares, 24,1 mm para los segundos premolares, 21,1 mm para primeros molares, 22,4 mm para los segundos molares y 23,3 mm a la zona de la tuberosidad maxilar. En este estudio, la arteria se localizó ligeramente más alta que en los estudios previos. Por el contrario, en el estudio de Wolf y cols.,16 la distancia desde el borde inferior de la arteria hasta la cresta alveolar en la región premolar fue de 13,5 mm, mostrando los resultados más bajos que hemos encontrado en la literatura.
Rysz y cols.,17 en su estudio más reciente, encontraron que la distancia media de la anastomosis entre la AIO y la AAPS fue superior a 15 mm en todos pacientes parcialmente edéntulos y, por lo tanto, concluyeron que la ostectomía para el diseño de la ventana ósea para el aumento del suelo del seno no debe alcanzar más de 15 mm desde el borde inferior de la cresta alveolar, siendo una distancia segura en este grupo.
En las imágenes por CBCT de nuestro estudio, encontramos una altura de la arteria hasta la cresta alveolar con un promedio de 15,9 mm (16,1 mm en mujeres y 15,5 mm en hombres, no habiendo diferencias radiográficas significativas entre los géneros), corroborando los resultados de los autores anteriormente mencionados.
En el área del 2º premolar es donde encontramos las mayores alturas, con 19,7 y 17,1 mm, seguida del área de los primeros y segundos molares, encontrando alturas de 13,2 y 15,6 mm en los primeros molares y 16,4 y 14,7 mm en los segundos molares.
En cuanto a la anastomosis de las arterias sinusales, Traxler y cols.,14 encontraron una anastomosis intraósea entre la AAPS y la AIO en todos los especímenes examinados. Esta contradicción significa que un canal intraóseo no detectado en una radiografía por TC no excluye su existencia, sino simplemente que no es visible, debido a su pequeño diámetro.
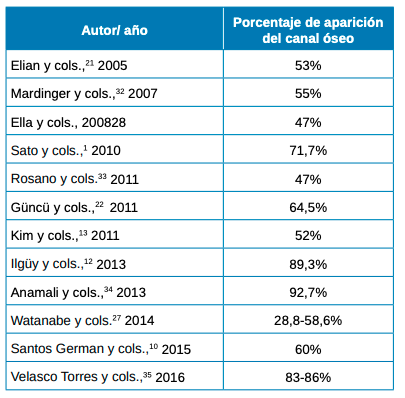
En 2005, Elian y cols.,21 observaron como las imágenes por tomografía computarizada (TC) no son tan sensibles, comparando los datos con los estudios de Solar y cols.,26 y Traxler y cols.,14 sobre cadáveres humanos.
La literatura científica informa sobre la aparición de esta estructura de canal óseo, siendo detectable en un gran porcentaje en imágenes por TC (Tabla 6).
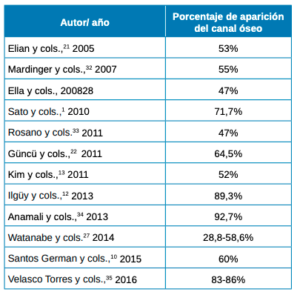
En los resultados de nuestro estudio, obtuvimos un porcentaje de visibilidad de un 43,91% frente a un 56,09% de no visibilidad, donde nos ha sido imposible detectar la posición de la arteria por medio de imágenes por CBCT en dos tipos de escáneres diferentes.
En un estudio de Mardinger y cols.,32 tan solo el 50% de los casos, el vaso tenía el tamaño necesario para ser localizado por TC, al igual que en un estudio sobre cadáveres de Rosano y cols.,33 el canal óseo se localizó radiográficamente en un 47% de los casos, mientras Anamali y cols.,34 por medio de CBCT obtiene resultados >90%. Estas diferencias en la detección de la anastomosis es posible que se hayan visto afectadas por la resolución y la falta de precisión de las exploraciones por TC al visualizar las arterias con un diámetro pequeño o sin vía intraósea35,36, ya que las TC tienen una resolución espacial de 0,5 a 0,8 mm, lo que significa que los canales finos pueden pasarse por alto en las imágenes27.
Otro dato a tener en cuenta es la ubicación intraósea/extraósea de la anastomosis. La posición intraósea se ubica dentro de la pared anterolateral del seno y la posición extraósea se ubica al borde de la cortical de la pared anterolateral y, a veces, localizada en una posición superficial, donde se halla por debajo del periostio de la pared anterolateral del seno28.
En el presente estudio, dichas ubicaciones han sido identificadas sin diferencias radiográficas significativas, siendo para la posición intraósea un 21,13% y para la extraósea un 22,76%.
Esto justificaría la contradicción entre una prevalencia del 100% de esta arteria encontrada por disección (identificada porque con frecuencia podía adherirse por completo a la membrana sinusal. Es decir, no radiográficamente visible y una prevalencia del 43,91% detectada mediante imágenes por CBCT.
Por otro lado, existen variaciones en la posición y el calibre de los canales de las arterias; solo en el 50% de los casos la arteria era de diámetro suficiente para ser localizada por imágenes por CBCT. Se recomienda el uso de diagnóstico por imagen como parte imprescindible de la evaluación prequirúrgica y el plan de tratamiento para crestas severamente atróficas, con el fin de evitar el riesgo de sangrado severo. Las imágenes por CBCT son el procedimiento más eficaz para poder estudiar los parámetros anatómicos de relevancia, como la existencia de una anastomosis de gran diámetro, el ancho de la pared anterolateral, una posible patología de la membrana sinusal y los septos sinusales.
Se ha informado en la literatura actual que un riesgo de sangrado severo se puede dar cuando el diámetro del vaso es mayor a 2 mm36. Cuanto mayor es el calibre, mayor es el riesgo de una hemorragia profusa. Hay que considerar la vascularización durante el abordaje con ventana lateral debido a las posibles complicaciones durante el procedimiento quirúrgico28. Aunque la laceración de esta arteria no es amenazante, debido al pequeño tamaño del vaso y a que su hemorragia generalmente se resuelve debida a una contracción reactiva, el daño a dicho vaso puede causar una hemorragia intensa, minimizando el campo de visión y puede llevar a un difícil despegamiento o una perforación de la membrana sinusal, lo que extenderá el tiempo de la cirugía31, 32.
En una serie de casos retrospectivos se informa sobre la ostectomía para el diseño de una ventana lateral, integrando tecnología piezoeléctrica junto con la instrumentación manual, siendo un medio actual eficaz para lograr la elevación de la membrana, al tiempo que minimiza el potencial de riesgos y complicaciones intraoperatorias. Sin embargo, se requieren más estudios controlados prospectivos y aleatorizados para calificar estos resultados37-43.
Diversos autores obtienen que los diámetros máximos de la AAPS y la AIO pueden llegar a 2 y 2,7 mm, pero se da muy ocasionalmente22, 26, 28. Uno de los estudios de Wolf y cols.,16 corrobora los resultados anteriores, encontrando que los diámetros más grandes de la AAPS eran de 2,8 mm.
Solar y cols.,26 informaron que el diámetro promedio de la AAPS en las imágenes por TC se encuentra en 1,6 mm y, de acuerdo con los estudios de Mardinger y cols.,32 afirman que los vasos con un diámetro <1 mm no representan un gran riesgo o una posible hemorragia durante los tratamientos quirúrgicos. Describieron que en la mayoría de los casos el calibre de la AAPS era inferior a 1 mm32. Solo el 29% de los casos tenían canales >1 mm y, por lo tanto, tenían riesgo de sangrado. La mayoría no logran ser lo suficientemente grandes como para ser detectados por técnicas radiográficas. Estos resultados coinciden con el estudio de Velasco-Torres y cols.,35 con resultados similares, ya que encontraron solo de un 20 a un 25% mostraban arterias de más de1 mm.
En el estudio de Ella y cols.,28 en 2008, llegaron a la conclusión de que en más del 10% de los casos existe riesgo de hemorragia debido a una arteria con un diámetro de más de 0,5 mm. En los pacientes cuya arteria tenía un diámetro 1 a 2 mm de diámetro, la probabilidad de un alto riesgo de hemorragia alcanzaba el 57%.
Los resultados del estudio de Güncü y cols.,22 informaron que la arteria tenía un calibre promedio de 1,3 mm. La observación está de acuerdo con estudios radiográficos en los que el calibre promedio de los vasos generalmente era de 1,2 mm, 1,1-1,3 mm y 1,5 mm, condiciendo además en que el calibre más grande se encontraba en los hombres13, 27, 28.
De acuerdo con los resultados de los autores anteriores, en nuestro estudio también encontramos que el diámetro de la arteria se comprendía entre 1 y 2 mm en la mayoría de los casos (32,52%), tanto en mujeres como en hombres, donde el promedio se obtuvo en 1,2 mm de diámetro. Las arterias con un calibre menor a 1 mm alcanzaron un 11,38%, con un promedio de 0,7 mm de diámetro. No detectamos en ningún caso un diámetro de la arteria >2 mm.
Las diferencias entre los resultados obtenidos en diversos estudios al medir el diámetro de la AAPS probablemente se deba a la resolución de los escáneres, a los diferentes criterios de inclusión y exclusión considerados y/o al menor número de muestras examinadas de los estudios27. Lo mismo sucede con la localización, como ya se ha mencionado.
Los autores mencionados anteriormente han aportado datos variables y métodos también diferentes, pero todos ponen en común y coinciden en que la anastomosis suministra la parte inferior del seno, desempeñando un papel importante en la integración del injerto y en la vascularización, y aunque su seccionamiento accidental no es una amenaza para la vida, el sangrado puede dificultar la visibilidad y el manejo de la membrana de Schneider5 .
En vista de los resultados obtenidos en nuestro estudio, podemos concluir que la altura desde la arteria alveolar posterior superior hasta la cresta alveolar en nuestra muestra ha sido, por orden de más a menos altura residual: primero los premolares, luego los segundos molares, y por último los primeros molares. No se han encontrado diferencias radiográficas significativas entre géneros en los parámetros de estudio medidos (visibilidad de la arteria, longitud a la cresta alveolar, diámetro y posición intra/extraósea).
La arteria alveolar posterior superior tiene un porcentaje de visibilidad de un 43,91%, siendo no visible en el 56,09% de los casos. Se ubica a una altura promedio de 15,9 mm desde la cresta alveolar, con 1,2 mm de diámetro promedio cuando se encuentra entre 1 y 2 mm, y cuando el diámetro es menor de 1 mm tiene un promedio de 0,7 mm. La posición es intraósea en un 21,13% y extraósea en un 22,76% de los casos. Las diferencias en la detección de la arteria se ven afectadas por la resolución y la falta de precisión de las exploraciones CBCT para visualizar arterias con un diámetro pequeño o sin vía intraósea.
Sato I, Kawai T, Yoshida S, Miwa Y, Imura K, Asaumi R, Sunohara M, Yosue T. Observing the bony canal structure of the human maxillary sinus in Japanese cadavers using cone beam CT. Okajimas Folia Anat Jpn 2010;87(3): 123-8.
Kasahara N, Morita W, Tanaka R, Hayashi T, Kenmotsu S, Ohshima H. The Relationships of the maxillary sinus with the superior alveolar nerves and vessels as demonstrated by Cone-Beam CT combined with μ-CT and histological analyses. Anat Rec 2016;299(5):669-78.
Khojastehpour L, Dehbozorgi M, Tabrizi R, Esfandnia S. Evaluating the anatomical location of the posterior superior alveolar artery in cone beam computed tomography images. Int J Oral Maxillofac Surg 2016;45(3):354-8.
Kim JK, Cho JH, Lee YJ, Kim CH, Bae JH, Lee JG, Yoon JH. Anatomical variability of the maxillary artery: findings from 100 Asian cadaveric dissections. Arch Otolaryngol Head Neck Surg 2010;136(8):813-8.
Bernardi S, Mummolo S, Ciavarelli LM, Li Vigni M, Continenza MA, Marzo G. Cone beam computed tomography investigation of the antral artery anastomosis in a population of Central Italy. Folia Morphol 2016;75(2):149-153.
Shahidi S, Zamiri B, Momeni Danaei S, Salehi S, Hamedani S. Evaluation of anatomic variations in maxillary sinus with the aid of Cone Beam Computed Tomography (CBCT) in a population in south of Iran. J Dent 2016;17(1):7-15.
Isolan GR, Rowe R, Al-Mefty O. Microanatomy and surgical approaches to the infratemporal fossa: an anaglyphic three-dimensional stereoscopic printing study. Skull Base 2007;17(5):285-302.
Tadokoro O, Umemura Y, Utsuno H, Inoue K. A case of a divided maxillary artery in the infratemporal fossa. Okajimas Folia Anat Jpn 2008;85(3):97-101.
Lee J, Kang N, Moon YM, Pang EK. Radiographic study of the distribution of maxillary intraosseous vascular canal in Koreans. Maxillofac Plast Reconstr Surg 2016;38(1):1.
Santos German IJ, Buchaim DV, Andreo JC, Shinohara EH, Capelozza AL, Shinohara AL, Rosa Junior GM, Pereira M, Buchaim RL. Identification of the bony canal of the posterior superior alveolar nerve and artery in the maxillary sinus: tomographic, radiographic, and macroscopic analyses. Scientific World Journal 2015; doi: 10.1155/2015/878205.
Choi J, Park HS. The clinical anatomy of the maxillary artery in the pterygopalatine fossa. J Oral Maxillofac Surg 2003; 61(1):72-8.
Ilgüy D, Ilgüy M, Dolekoglu S, Fisekcioglu E. Evaluation of the posterior superior alveolar artery and the maxillary sinus with CBCT. Braz Oral Res 2013;27(5):431-7.
Kim JH, Ryu JS, Kim KD, Hwang SH, Moon HS. A radiographic study of the posterior superior alveolar artery. Implant Dent 2011;20(4):306-10.
Traxler H, Windisch A, Geyerhofer U, Surd R, Solar P, Firbas W. Arterial blood supply of the maxillary sinus. Clin Anat 1999;12(6):417-21.
Chitsazi MT, Shirmohammadi A, Faramarzi M, Esmaieli F, Chitsazi S. Evaluation of the position of the posterior superior alveolar artery in relation to themaxillary sinus using the Cone-Beam computed tomography scans. J Clin Exp Dent 2017;9(3): e394-e399.
Wolf MK, Rostetter C, Stadlinger B, Locher M, Damerau G. Preoperative 3D imaging in maxillary sinus: brief review of the literature and case report. Quintessence Int 2015;46(7):627-31.
Rysz M, Ciszek B, Rogowska M, Krajewski R. Arteries of the anterior wall of the maxilla in sinus lift surgery. Int J Oral Maxillofac Surg 2014;43(9):1127-30.
Yoshida S, Kawai T, Asaumi R, Miwa Y, Imura K, Koseki H, Sunohara M, Yosue T, Sato I. Evaluation of the blood and nerve supply patterns in the molar region of the maxillary sinus in Japanese cadavers Okajimas Folia Anat Jpn 2010;87(3):129-33.
Cruz LA, Palacios DE, Miranda JE, Cazar Me, Martínez PA. CBCT evaluation of the alveolar antral artery in a mexican cohort and its relationship to maxillary sinus floor lifting. Revista ADM 2016; 73 (6): 286-290.
Zijderveld SA, van den Bergh JP, Schulten EA, ten Bruggenkate CM. Anatomical and surgical findings and complications in 100 consecutive maxillary sinus floor elevation procedures. J Oral Maxillofac Surg 2008;66(7):1426-38.
Elian N, Wallace S, Cho SC, Jalbout ZN, Froum S. Distribution of the maxillary artery as it relates to sinus floor augmentation. Int J Oral Maxillofac Implants 2005;20(5):784-7.
Güncü GN, Yildirim YD, Wang HL, Tözüm TF. Location of posterior superior alveolar artery and evaluation of maxillary sinus anatomy with computerized tomography: a clinical study. Clin Oral Implants Res 2011;22(10):1164- 7.
Pandharbale AA, Gadgil RM, Bhoosreddy AR, Kunte VR, Ahire BS, Shinde MR, Joshi SS. Evaluation of the Posterior Superior Alveolar Artery Using Cone Beam Computed Tomography. Pol J Radiol 2016;81:606-610.
Hur MS, Kim JK, Hu KS, Bae HE, Park HS, Kim HJ. Clinical implications of the topography and distribution of the posterior superior alveolar artery. J Craniofac Surg 2009;20(2):551-4.
Boyne PJ, James RA. Grafting of the maxillary sinus floor with autogenous marrow and bone. J Oral Surg 1980;38(8):613–616.
Solar P, Geyerhofer U, Traxler H, Windisch A, Ulm C, Watzek G. Blood supply to the maxillary sinus relevant to sinus floor elevation procedures. Clin Oral Implants Res 1999;10(1):34-44.
Watanabe T, Shiota M, Gao S, Imakita C, Tachikawa N, Kasugai S. Verification of posterior superior alveolar artery distribution in lateral wall of maxillary sinus by location and defect pattern. Quintessence Int. 2014;45(8):673-8.
Ella B, Sédarat C, Noble Rda C, Normand E, Lauverjat Y, Siberchicot F, Caix P, Zwetyenga N. Vascular connections of the lateral wall of the sinus: surgical effect in sinus augmentation. Int J Oral Maxillofac Implants 2008;23(6):1047-52.
Rosano G, Taschieri S, Gaudy JF, Weinstein T, Del Fabbro M. Maxillary sinus vascular anatomy and its relation to sinus lift surgery. Clin Oral Implants Res 2011;22(7):711-5.
Varela-Centelles P, Loira-Gago M, Seoane-Romero JM, Takkouche B, Monteiro L, Seoane J. Detection of the posterior superior alveolar artery in the lateral sinus wall using computed tomography/cone beam computed tomography: a prevalence meta-analysis study and systematic review. Int J Oral Maxillofac Surg 2015;44(11):1405-10.
Testori T, Wallace SS, Del Fabbro M, Taschieri S, Trisi P, Capelli M, Weinstein RL. Repair of large sinus membrane perforations using stabilized collagen barrier membranes: surgical techniques with histologic and radiographic evidence of success. Int J Periodontics Restorative Dent 2008;28(1):9-17.
Mardinger O, Abba M, Hirshberg A, Schwartz-Arad D. Prevalence, diameter and course of the maxillary intraosseous vascular canal with relation to sinus augmentation procedure: a radiographic study. Int J Oral Maxillofac Surg 2007;36(8):735-8.
Rosano G, Taschieri S, Gaudy JF, Weinstein T, Del Fabbro M. Maxillary sinus vascular anatomy and its relation to sinus lift surgery. Clin Oral Implants Res 2011;22(7):711-715.
Anamali S, Avila-Ortiz G, Elangovan S, Qian F, Ruprecht A, Finkelstein M, Allareddy V. Prevalence of the posterior superior alveolar canal in cone beam computed tomography scans. Clin Oral Impl Res 2015;26(1):8-12.
Velasco-Torres M, Padial-Molina M, Alarcón JA, OʼValle F, Catena A, GalindoMoreno P. Maxillary sinus dimensions with respect to the posterior superior alveolar artery decrease with tooth loss. Implant dent 2016;25(4):464-70.
de Oliveira GJPL, Abdala MA, Nary-Filho H, Sakakura CE, Garcia VG, Leite FC. Tomographic evaluation of prevalence, position, and diameter of the intraosseous branch of the posterior superior alveolar artery in fully edentulous individuals. J Craniofac Surg 2017;28(3): e279-e283.
Wallace SS, Mazor Z, Froum SJ, Cho SC, Tarnow DP. Schneiderian membrane perforation rate during sinus elevation using piezosurgery: clinical results of 100 consecutive cases. Int J Periodontics Restorative Dent 2007;27(5):413-9.
Hwang JH, Jung BY, Lim CS, Cha IH, Park W. Posterior maxillary segmental osteotomy concomitant with sinus lift using a piezoelectric device. J Oral Maxillofac Surg 2011;69(9):2339-44.
Blus C, Szmukler-Moncler S, Salama M, Salama H, Garber D. Sinus bone grafting procedures using ultrasonic bone surgery: 5-year experience. Int J Periodontics Restorative Dent 2008;28(3):221-9.
Toscano NJ, Holtzclaw D, Rosen PS. The effect of piezoelectric use on open sinus lift perforation: a retrospective evaluation of 56 consecutively treated cases from private practices. J Periodontol 2010;81(1):167-71.
Cassetta M, Ricci L, Iezzi G, Calasso S, Piattelli A, Perrotti V. Use of piezosurgery during maxillary sinus elevation: clinical results of 40 consecutive cases. Int J Periodontics Restorative Dent 2012;32(6): e182-8.
Cho SC, Wallace SS, Froum SJ, Tarnow DP. Influence of anatomy on Schneiderian membrane perforations during sinus elevation surgery: three-dimensional analysis. Pract Proced Aesthet Dent 2001;13(2):160-3.
Vercellotti T, De Paoli S, Nevins M. The piezoelectric bony window osteotomy and sinus membrane elevation: introduction of a new technique for simplification of the sinus augmentation procedure. Int J Periodontics Restorative Dent 2001;21(6):561-7.

Gómez Pérez, Víctor
Graduado en Odontología y Máster en Cirugía e Implantología Bucal Avanzada por la Universidad Europea (UEM).
Molinos Morera, Jaime
Máster en Implatología Oral Avanzada por la UEM. Profesor del Máster en Cirugía e Implantología Bucal Avanzada en la UEM. Continuing Dental Education Prograde in NewYork (NYU).
Manrique García, Carlos
Doctor en Odontología por la Universidad Complutense de Madrid. Profesor del Máster Universitario en Cirugía e Implantología Bucal Avanzada en la UEM.
Martín Ares, María
Doctora por la Universidad Complutense de Madrid. Board en Cirugía Bucal. Profesora del Máster Universitario en Cirugía e Implantología Bucal Avanzada en la UEM.
Trapote Mateo, Sergio
Doctor en Medicina y Cirugía por la Universidad Complutense de Madrid. Codirector del Máster Universitario en Cirugía e Implantología Bucal Avanzada en la UEM.
Jiménez García, Jaime
Doctor en Odontología por la Universidad Complutense de Madrid. Codirector del Máster Universitario en Cirugía e Implantología Bucal Avanzada en la UEM.