Caso clínico
Veneri N, Al-Nakash D B, Martínez Rodríguez N, Leco Berrocal I, Madrigal-Martínez Pereda C, Martínez-González J M. Pénfigo Vulgar mucoso: a propósito de un caso. Revisión de la literatura. Cient. Dent. 2021; 18; 4; 247-253
Pénfigo Vulgar mucoso: a propósito de un caso. Revisión de la literatura
Introducción: El Pénfigo Vulgar (PV) es una enfermedad de origen autoinmune caracterizada por causar ampollas intraepidérmicas en piel y mucosas, como consecuencia de la agresión de autoanticuerpos hacia varios tipos de proteínas desmosómicas. El elemento eruptivo primordial es la ampolla, que puede presentarse de manera individual o en coalescencia con la consecuente formación de placas erosivo-costrosas. En el 90% de los casos las lesiones afectan a la mucosa oral, mientras que en el 50-70% de los mismos constituyen la primera manifestación de la enfermedad.
Objetivo: Se presenta un caso clínico de PV y una revisión bibliográfica actualizada, con el objetivo de analizar sus factores etiológicos y sus opciones terapéuticas.
Caso clínico: Se presenta el caso de un paciente varón, de 71 años, fumador, con condición prediabética y síndrome de Guillain Barré remitido al Servicio de Cirugía Bucal e Implantología del Hospital Virgen de la Paloma de Madrid con un cuadro clínico caracterizado por infección oral y pérdida de peso. Una vez confirmado el diagnóstico de PV mucoso mediante examen histopatológico, se estableció una terapia con corticoides sistémicos obteniendo una remisión casi completa de las lesiones. Tras varias semanas de tratamiento su dermatólogo decidió suspender los corticoides para llevar a cabo, sin éxito, una terapia sustitutiva con inmunosupresores. La recidiva de las lesiones, unida a los efectos adversos causados por la nueva terapia, obligó a reconsiderar la suministración de corticoides con una resolución positiva de la enfermedad.
Conclusiones: No existe una estrategia terapéutica bien establecida para el tratamiento del PV. El objetivo del tratamiento consiste en conseguir una remisión clínica prolongada mediante la suministración de corticoesteroides. El tratamiento con inmunosupresores (azatioprina, micofenolato mofetil) no ha demostrado ser una alternativa válida a los corticoides, pero sí puede ser una buena opción como tratamiento adyuvante con el fin de reducir las dosis de corticoides.
Introduction: Pemphigus Vulgaris is an autoimmune disease characterized by causing intraepidermal blisters on the skin and mucosa, as a consequence of the aggression of autoantibodies towards various types of desmosomal proteins. The primary eruptive element is the blister, which can appear in coalescence with the consequent formation of erosive-crusted plaques. In 90% of cases lesions affect the oral mucosa, while in 50-70% they are the first manifestation of the disease.
Objective: We aim to report a case of Pemphigus Vulgaris and an updated literature review to analyse its etiological factors and treatment options.
Clinical case: We present the case of a 71-year-old male patient, smoker, with prediabetic condition and sindrome Guillain Barré referred to the Oral Surgery and Implantology Service of the Virgen de la Paloma Hospital in Madrid with a clinical picture characterized by oral infection. Once the diagnosis of mucosal PV was confirmed, a systemic corticosteroid therapy was established, obtaining almost complete remission of the lesions. After several weeks of treatment, his dermatologist decided to suspend the corticosteroids to carry out unsuccessful immunosuppressant replacement therapy. The recurrence of the lesions, together with the adverse effects caused by the new therapy, forced the reconsideration of the supply of corticosteroids with a positive resolution of the disease.
Conclusions: There is no definitive therapeutic strategy for the treatment of Pemphigus Vulgaris. The goal of treatment is to achieve a prolonged clinical remission by supplying corticosteroids. Immunosuppressants have not been shown to be a valid alternative to corticosteroids, but they are a good option if they are supplied together with corticoids in order to reduce their doses.
El término pénfigo reúne un grupo de enfermedades autoinmunes caracterizadas por causar ampollas intraepidérmicas en piel y mucosas, como consecuencia de la agresión de autoanticuerpos hacia varios tipos de proteínas desmosómicas. En base a las manifestaciones histopatológicas, así como a los tipos de autoanticuerpos y antígenos implicados, se distinguen varias formas de pénfigo: vulgar, cicatricial, foliáceo, paraneoplásico, herpetiforme e IgA.
Clínicamente el elemento eruptivo primordial es la ampolla, que puede presentarse de manera individual o en coalescencia con la consecuente formación de placas erosivo-costrosas. En el 90% de los casos las lesiones afectan a la mucosa oral, mientras que en el 50-70% de los mismos constituyen la primera manifestación de la enfermedad1 . Es una patología de curso progresivo que, en sus formas más graves y sin un adecuado tratamiento, puede provocar un fuerte desequilibrio electrolítico, sepsis e insuficiencia cardiaca2 .
Desde una perspectiva epidemiológica, el pénfigo muestra una distribución desigual según factores étnicos, geográficos y sexuales. Así, mientras que en Europa Central la incidencia de Pénfigo Vulgar (PV) es de 0,5 nuevos casos por millón de habitantes al año, en Israel las cifras llegan hasta los 16,1 casos por millón al año, afectando en particular modo a los judíos de la etnia Ashkenazi3-4. Varios estudios señalan una mayor propensión por el género femenino, con una proporción mujer:hombre que oscila entre 1:1 en Finlandia y 5:1 en EEUU5 .
Si bien es cierto que las tasas de mortalidad actuales raramente superan el 5% en los países desarrollados, es importante recordar que se trata de una afección potencialmente mortal y cuyos signos se pueden detectar de forma temprana en la consulta odontológica6 . El dolor, junto con la necesidad de emprender tratamientos de larga duración, obligan a estos pacientes a acudir con frecuencia a especialistas capaces de mejorar su calidad de vida.
El objetivo de esta publicación es la descripción de un caso de PV mucoso limitado a la región oral, exponiendo las últimas actualizaciones sobre la etiología, las manifestaciones clínicas, el diagnóstico y el tratamiento de la enfermedad.
Varón de 71 años, fumador, con condición prediabética y síndrome de Guillain Barré, es remitido al Servicio de Cirugía Bucal e Implantología del Hospital Virgen de la Paloma de Madrid por cuadro clínico caracterizado por pérdida de peso (6 kg en los últimos meses) e infección bucal con dolor.
En las dos semanas precedentes acudió a urgencias en repetidas ocasiones presentando, según los informes médicos aportados por el paciente, lesiones eritematosas periodontales con placas blanquecinas y odinofagia. El tratamiento proporcionado en los servicios de urgencias (amoxicilina 875 mg + ácido clavulánico 125 mg y metamizol 575 mg) consiguió sólo un alivio temporal seguido por una reagudización en los días sucesivos.
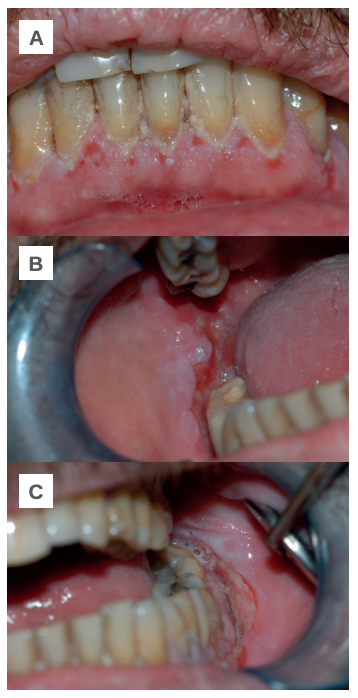
Tras la exploración intraoral se confirma que la mayor parte de las lesiones se localizan en el tejido gingival de la región antero-inferior, en mucosa yugal a nivel de los molares inferiores y en el fondo vestibular (Figuras 1-A, B y C). A la espera de un diagnóstico definitivo se le prescribe acetónido de triamcinolona 0,1%, con el que mejora en los tres días siguientes. Tras una nueva reagudización se intensifica el tratamiento corticoide suministrando dexametasona 4 mg inyectable (1 día/3 días) y 4 mg vía oral (1 día/5 días), con el que obtiene una notable mejoría durante las dos semanas siguientes.
A: región antero inferior. B: mucosa yugal derecha y fondo de vestíbulo. C: mucosa yugal izquierda y fondo de vestíbulo.
Obtenidos los resultados del examen histopatológico y confirmada la presencia de AC antidesmogleina 3, se diagnostica PV mucoso y se establece una nueva terapia con prednisona 30 mg siguiendo una pauta con concentraciones decrecientes de manera progresiva: una toma cada 12 h durante los primeros 15 días; 1 toma cada 24 horas en los 7 días sucesivos y una toma cada 48 h en los últimos 7 días.
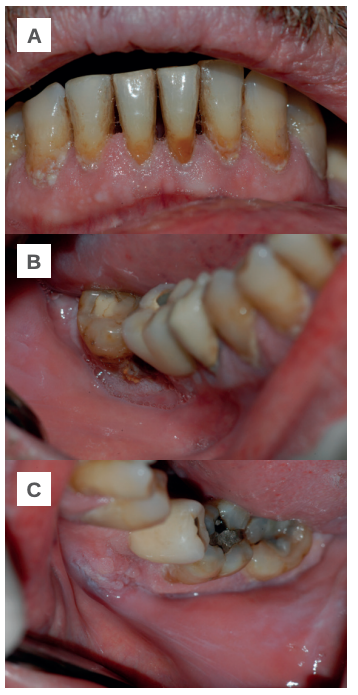
Transcurridos dos meses su dermatólogo sustituye la prednisona por 25 mg de azatioprina cada 24 horas, pero tras tres semanas es necesario interrumpir el tratamiento por fuertes molestias gastrointestinales y una ligera recidiva de las lesiones en la mucosa yugal. Con el fin de volver a estabilizar al paciente, se le prescriben bajas dosis de prednisona (10 mg cada 24 horas) con resultados positivos y una considerable remisión de las lesiones. El paciente se mantiene asintomático y sin recidiva de nuevas lesiones (Figuras 2 A- B y C).
Las lesiones producidas por el PV son consecuencia de la agresión de varios tipos de autoanticuerpos a los desmosomas, proteínas responsables del mantenimiento de las uniones celulares intraepidérmicas. En la literatura, todos los autores parecen coincidir en que los anticuerpos IgG1 e IgG4 actúan contra epítopos específicos de las desmogleínas 1 y 3 (Dsg1 y Dsg3), dos cadherinas implicadas en la capacidad de adhesión intercelular de los desmosomas7 . Así mismo, se ha demostrado que la localización de las lesiones depende del tipo de Dsg susceptible al ataque autoinmune, dado que la distribución de éstas no es la misma en la epidermis que en las membranas mucosas8 .
Cuando las inmunoglobulinas reaccionan frente a la Dsg 3 se producen lesiones mucosas, ya que éstas se encuentran en todo su espesor, mientras que en la epidermis se manifiestan sólo en profundidad. Si los anticuerpos reaccionan frente a la Dsg 1 se producen lesiones cutáneas, dado que se expresan en la totalidad del espesor de la epidermis y en cantidades mínimas en las mucosas. En las formas mixtas se observan injurias de los mismos anticuerpos frente a ambos tipos de Dsg, produciéndose así lesiones cutáneo-mucosas. Según la ‘hipótesis compensatoria’, la presencia de uno de los dos tipos de Dsg (en cantidades suficientes) compensaría el defecto de la otra, lo que explicaría porqué el PV puede manifestarse de manera exclusiva en piel o en mucosas9-10. Las manifestaciones clínicas del paciente tratado en el presente caso clínico fueron exclusivamente mucosas, con confirmación diagnóstica de AC anti-Dsg3.
Como suele suceder con la mayor parte de las enfermedades autoinmunes, el desarrollo de PV depende de la interacción entre factores genéticos predisponentes y factores desencadenantes o inductores. En relación a los primeros se ha observado una asociación entre la enfermedad y la presencia de polimorfismos genéticos alterados en los antígenos de los complejos mayores de histocompatibilidad, relación que ha sido demostrada por Yan y cols.,11 en un meta-análisis de 2012. Se cree que tales alteraciones modifican la conformación y las cargas eléctricas de las moléculas de HLA, incrementando así su afinidad por las Dsg1 y Dsg3, lo que llevaría a la creación de autoanticuerpos12 . Por lo que respecta a los factores desencadenantes, son pocos los estudios que se han llevado a cabo con rigurosidad y hacen falta pruebas más concluyentes. Entre los factores propuestos destacan los fármacos del grupo tiol13 , factores hormonales relacionados con el embarazo, radiaciones UV e ionizantes14-15, así como infecciones16. Sorprende como, según un estudio sobre los potenciales factores desencadenantes del PV, el tabaco muestra un cierto efecto protector al estimular la adherencia entre queratinocitos17. En el caso aquí descrito es importante mencionar que el paciente padeció, años atrás, un brote neurodegenerativo diagnosticado como síndrome de Guillain Barré. Aunque no sea posible establecer una relación causal, es cierto que ambas enfermedades pueden desencadenarse a partir de episodios infecciosos.
A nivel clínico la lesión primaria del PV es la ampolla, el resto de lesiones coalescentes (costras, erosiones y restos epiteliales) son el resultado de su evolución natural18. La ampolla suele presentar dimensiones variables, el contenido puede ser seroso, purulento o hemorrágico y puede asociarse a ampollas limítrofes con la sucesiva formación de placas erosivo-costrosas. En más del 50% de los casos el debut se localiza en la mucosa oral; según el área bucal interesada es posible encontrar erosiones irregulares, grandes y en ocasiones recubiertas por lesiones blanquecinas en la mucosa yugal; erosiones, costras y restos epidérmicos en labios; erosiones en el tejido gingival alrededor de los dientes; erosiones aisladas o coalescentes en paladar y erosiones especialmente dolorosas en la lengua19. En el PV cutáneo suelen localizarse en tronco, ingles, axilas, cuero cabelludo y cara20. Las lesiones observadas en este paciente afectaron a la mucosa yugal y a la encía del sector antero-inferior, constituyendo un límite importante para llevar a cabo una higiene oral adecuada y con la consecuente acumulación de placa en las caras vestibulares de sus dientes. No se registraron manifestaciones en el paladar, lengua o labios.
La fragilidad epidérmica del PV se pone de manifiesto ante cualquier presión que se realice sobre el epitelio, fenómeno que puede comprobarse mediante los signos de Nikolsky y Asboe-Hansen o Nikolsky tipo II. El primero consiste en ejercer una presión tangencial sobre el epitelio para comprobar su despegamiento, mientras que el segundo se lleva a cabo presionando de forma vertical sobre la ampolla, lo que conlleva un aumento periférico de su tamaño. Cabe tener en cuenta que cualquier intervención en boca deberá realizarse con suma precaución, con el fin de no originar nuevas lesiones mediante las presiones tipo Nikolsky durante las fases agudas de la enfermedad. Así, en el caso que aquí se presenta se evitó la realización de profilaxis con ultrasonidos hasta la curación de la mayor parte de las lesiones, mientras que las fotografías intraorales pudieron llevarse a cabo con un abrebocas dada la ausencia de lesiones en la región labial.
Los métodos diagnósticos definitivos son la biopsia, la inmunofluorescencia directa, la inmunofluorescencia indirecta y la técnica ELISA. Sólo mediante estas pruebas será posible confirmar el diagnóstico de presunción de PV y descartar otras patologías con signos análogos como estomatitis aftosa, estomatitis herpética, eritema multiforme, StevenJhonson, liquen plano, lupus eritematoso sistémico, pénfigo paraneoplásico y penfigoide de membranas mucosas para el PV mucoso y de penfigoide, dermatosis IgA linear, eritema multiforme ampolloso y dermatitis herpetiforme para el PV cutáneo. Algunos autores incluyen también la epidermólisis bullosa, candidosis, estomatitis aftosa recurrente y Beçhet21 .
A nivel histopatológico, el primer rasgo observable es la aparición de edema intercelular en las capas más profundas de la epidermis, seguido por fenómenos de acantólisis. Siempre que quiera llevarse a cabo, esta técnica debe realizarse mediante una exéresis completa de ampollas de reciente aparición o, en su defecto, en la mucosa contigua al área erosionada22. Sólo así podrán observarse adecuadamente las ampollas intraepidérmicas, con queratinocitos acantolíticos, limitadas inferiormente por las células basales de la epidermis. Dada la pericia requerida para disecar ampollas en territorio oral, en el presente caso fue necesario llevar a cabo varias tomas que permitieran observar una sección completa de todas las capas y confirmar la presencia de ampollas intraepidérmicas suprabasales.
Respecto a la inmunofluorescencia directa (IFD), prueba de elección en el caso descrito y que permite la identificación de depósitos intercelulares de IgG, la literatura examinada sugiere realizar la prueba sobre la mucosa perilesional. Cabe mencionar que, en el momento de tomar la biopsia y cuando hay una sospecha diagnóstica, los patólogos recomiendan enviar la muestra en fresco. No es recomendable enviarla en formol, ya que suele distorsionar la muestra obligando a repetir la toma con la consecuente molestia para el paciente.
La detección de anticuerpos circulantes resulta muy útil como marcador de la actividad de la enfermedad y se puede realizar mediante dos pruebas diferentes: la inmunofluorescencia indirecta (IFI) y la técnica ELISA. Esta última presenta la ventaja de ser una prueba sencilla y con menos falsos negativos que la IFI23. Sin embargo, las condiciones de este paciente no requirieron la ejecución de tales pruebas, por lo que se consideró suficiente monitorizar la evolución de las lesiones. Pruebas diagnósticas más sofisticadas como lo son el inmunoblot y la inmunoprecipitación, no son asequibles en términos económicos y técnicos para su uso a nivel clínico.
En cuanto al tratamiento, el nivel de evidencia científica es actualmente muy escaso: existen muy pocos ensayos aleatorios controlados o con muestras poblacionales suficientemente amplias, una sola revisión incluida en Cochrane24, así como una sola revisión sistemática dedicada exclusivamente al PV y con criterios PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)25 .
El propósito terapéutico que se persigue es la remisión clínica prolongada, ya que la respuesta a la terapia no es inmediata y requiere ajustes continuos según la reacción de cada paciente. La piedra angular es el uso de glucocorticoides, cuya introducción en la década de los 50 consiguió disminuir el índice de mortalidad desde un 75% hasta un 30%. Sin embargo, ésta no cuenta con un respaldo científico suficiente ni con un protocolo estandarizado y sus graves efectos adversos como hipertensión arterial (HTA), diabetes mellitus (DM), infecciones, úlcera gástrica, osteoporosis, necrosis de la cabeza del fémur, glaucoma y cataratas constituyen su mayor obstáculo. Dentro del abanico de posibilidades que ofrecen los corticoides, en la literatura se señalan tratamientos sistémicos (vía oral e IV) y tópicos. Desde la mitad del siglo pasado, se intenta protocolizar su uso mediante varios modelos que aún hoy en día sirven de referencia.
En 1984, Lever26, publicó un estudio sobre 84 pacientes a los que se trató con dos terapias alternativas según la gravedad de las lesiones, obteniendo una remisión total en 47 de ellos. En los casos no severos se suministraron 40 mg de prednisona junto con azatioprina y en días alternos, durante un periodo mínimo de un año; en los casos severos se suministraron 200/400 mg de prednisona al día durante 5-10 semanas, para reducir después progresivamente a 40 mg/día la 1ª semana, 30 mg/día la 2ª semana, 25 mg/día la 3ª semana y pasar sucesivamente al tratamiento para formas no severas.
Ese mismo año, Bystrin27, publicó una revisión sistemática en la que propuso un tratamiento subdividido en tres fases: control, consolidación y mantenimiento. En la fase de control se ejecutaba un aumento progresivo de prednisona desde un mínimo inicial de 80 mg/día hasta alcanzar un máximo de 240 mg/día en 7 días. La fase de consolidación consistía en obtener la curación del 80% de las lesiones manteniendo las dosis efectivas. En la fase de mantenimiento se disminuían gradualmente las dosis para volver a alcanzar los 80 mg/día. A partir de ese momento se sugería bajar 10 mg/día, en una serie de días alternos (80 – 70 – 80 – 60 – 80 – 50 – etc), hasta anular las dosis en los días sujetos a la disminución. Si aparecían nuevas lesiones trataban con triamcinolona intralesional y, si no surtía efecto, se volvía a aumentar las dosis de corticoides un 25 % cada semana hasta conseguir curarlas.
Hoy en día el European Dermatology Forum aconseja manejarse con dosis de prednisona comprendidas entre 0.5 mg y 1.5 mg/kg diarios, cantidades superiores a las suministradas con eficacia al paciente de este caso. Si no se obtuviera respuesta tras dos semanas de tratamiento, siempre según la EDF, puede subirse la dosis hasta los 2 mg/kg al día. Otros autores añaden, para las formas más graves, tratamientos IV con dosis de hasta 1 g al día durante 3-5 días consecutivos y ahí donde hubiese que superar tal dosis, 1 g/día de metilprednisolona y 300 mg/ día de dexametasona durante 3 días consecutivos (‘Pulse Therapy’)21. Tal y como se pudo corroborar durante el tratamiento de este paciente, es posible obtener un alivio de la sintomatología combinando el tratamiento sistémico con aplicaciones tópicas de propionato de clobetasol, acetónido de triamcinolona, pimecrolimus o tacrolimus28 .
La duración de la terapia de mantenimiento, así como su eventual interrupción, dependerán de la fase de monitorización de la patología y, por lo tanto, de la evolución de la enfermedad en cada paciente. En su ‘Guideline for diagnosis and treatment’ el European Dermatology Forum y la European Academy of Dermatology and Venereology (EADV), aconsejan reducir progresivamente el tratamiento con corticoides orales hasta alcanzar la fase de consolidación, es decir hasta que no se hayan desarrollado nuevas lesiones durante un mínimo de 2 semanas y siempre que el 80% de las lesiones hayan cicatrizado. Además, hay que tener en cuenta que si durante la reducción gradual de los corticoides se produjera la reaparición de más de tres lesiones será necesario volver a la última dosis hasta lograr el control de las lesiones en 2 semanas, para volver a disminuir gradualmente. Si no se consiguiera el control de la enfermedad, se volverá a la dosis inicial2 .
En los últimos 20 años se han propuesto prometedoras terapias alternativas a los corticoides para conseguir limitar sus efectos secundarios, pero la evidencia científica sobre su uso exclusivo es aún muy escasa29. Actualmente se recomienda su suministración de manera conjunta con los corticoides con el único fin de reducir las dosis de estos últimos25 .
En su más reciente publicación y como segunda línea de tratamiento, el EDF aconseja el uso de los inmunosupresores azatioprina o micofenolato mofetil en aquellos casos refractarios a la prednisona o en situaciones en las que los corticoides estén contraindicados. Así mismo recomiendan el uso de Rituximab, inmunoglobulinas IV de origen humano (IVIG), plasmaféresis, ciclofosfamida, Dapsone y Methotrexato solo en los casos en los que no se pueda suministrar inmunosupresores. No obstante, hay autores que sugieren el uso de estas terapias como primera línea de tratamiento.
En el caso que aquí se refiere el tratamiento exclusivo con azatioprina debió interrumpirse, debido a efectos secundarios de carácter gastrointestinal y a una leve recidiva de las lesiones. La azatioprina es un antagonista del metabolismo de las pirinas y de la síntesis de ADN, ARN y proteínas, cuyos efectos principales son la reducción del número de monocitos y células de Langerhans, así como la disminución de la actividad de los linfocitos y las gammaglobulinas. Entre sus efectos secundarios figuran leucopenia, trombocitopenia, anemia, pancitopenia, hepatotoxicidad y mayor propensión a infecciones y neoplasias. Bystrin27 señala remisiones de entre el 28% y el 45% en pacientes en los que se ha tratado con corticoides y azatioprina en dosis de 1-3 mg/kg/día y con un inicio gradual partiendo de 50 mg/día. En conclusión, parece que la azatioprina es un fármaco útil para la reducción de las dosis de corticoides, pero no muy efectivo si utilizado de forma exclusiva.
No sucede lo mismo con el micofenolato mofetil (MMF), otro inmunosupresor cuya ventaja con respecto a la azatioprina es su menor hepatotoxicidad, pero que resulta menos efectivo en la reducción de las dosis de corticoesteroides. El MMF inhibe la inosina monofosfato deshidrogenasa, reduciendo de esta manera la producción de linfocitos B y T. Los efectos secundarios incluyen neutropenia, linfopenia, mialgia y problemas gastrointestinales. Powell y cols.30 encontraron una remisión del 71% en un estudio con 42 casos en los que se suministró micofenolato junto con 0,15 mg/kg/día de prednisona. Chams-Davatchi y cols.31 mostraron, en un estudio con 57 participantes, que el efecto reductor de dosis de esteroides del MMF fue inferior al de la azatioprina32 .
En aquellos casos en los que no era posible suministrar estos inmunosupresores, en el pasado varios clínicos proponían el uso de ciclofosfamida, un agente alquilante que afecta a la producción de anticuerpos y linfocitos B. Pero sus graves efectos secundarios como infertilidad, neoplasias, linfopenia y sepsis obligan a mantener una vigilancia continua del paciente32 .
Merece la pena mencionar que en la literatura se pueden encontrar decenas de publicaciones sobre los prometedores resultados del Rituximab, pero lo cierto es que aún no se han publicado ensayos controlados de calidad que arrojen luz sobre su eficacia25. Se trata de un anticuerpo monoclonal quimérico múrido, que se une al receptor de superficie CD20 de los linfocitos B induciendo su lisis. Es un fármaco bien tolerado y su principal desventaja es la posibilidad de contraer infecciones por su efecto inmunosupresor.
Quizás, uno de los tratamientos alternativos más eficaces sea la suministración IV de inmunoglobulinas de donantes humanos (IVIG). Su forma de acción es compleja, sinérgica y aún no bien comprendida. Es un tratamiento relativamente seguro, con pocos efectos adversos y cuyo resultado principal consiste en la eliminación de anticuerpos patógenos circulantes. La principal desventaja es su baja disponibilidad. Otro tratamiento con resultados y desventajas análogas es la plasmaféresis, que consiste en la remoción de anticuerpos patógenos mediante un proceso de depuración sanguínea extracorpórea.
Por último, es posible encontrar estudios en los que se incluyen potentes antiinflamatorios como el dapsone y el metotrexato. El dapsone es usado sobretodo en la fase de mantenimiento del PV. Es un fármaco con un perfil de seguridad relativamente alto en dosis comprendidas entre 50 y 200 mg/día por vía oral, pero requiere vigilancia continua por la posibilidad de causar trastornos hematológicos como anemia hemolítica33. El metotrexato es un antagonista del folato que inhibe la enzima dihidrofolato reductasa, consiguiendo efectos antiinflamatorios y de reducción de la proliferación celular. Es poco caro y con buena disponibilidad, pero puede causar infecciones, toxicidad hemática e intolerancia gastrointestinal34 .
El PV es una patología de difícil manejo y sin una estrategia terapéutica bien establecida. El objetivo del tratamiento es la remisión clínica prolongada mediante la suministración de corticoides. Los tratamientos con inmunosupresores parecen ser de ayuda para disminuir las dosis de glucocorticoides, pero hasta ahora ningún estudio ha conseguido demostrar su eficacia como tratamientos sustitutivos.
Porro A, Arai C, Corsi MC, Simoes MM. Pemphigus vulgaris. An Bras Dermatol 2019; 93:264-78.
Hertl M, Jedlickova H, Karpati S, y cols. Guideline for diagnosis and treatment – European Dermatology Forum. J Eur Acad Dermatology Venereol 2015;29:405- 14.
Hammers CM, Stanley JR. Mechanisms of Disease: Pemphigus and Bullous Pemphigoid. Annu Rev Pathol Mech Dis 2016;11:175-97.
Müller R, Heber B, Hashimoto T, y cols. Autoantibodies against desmocollins in European patients with pemphigus. Clin Exp Dermatol 2009;34:898-903.
Kridin K. Pemphigus group: overview, epidemiology, mortality, and comorbidities. Immunol Res 2018;66:255-70.
Kridin K, Zelber-Sagi S, Bergman R. Mortality and cause of death in patients with pemphigus. Acta Derm Venereol 2017;97:607-11.
Tsunoda K, Ota T, Suzuki H, y cols. Pathogenic autoantibody production requires loss of tolerance against desmoglein 3 in both T and B cells in experimental pemphigus vulgaris. Eur J Immunol 2002;32: 627-33.
Amagai M, Hashimoto T, Shimizu N, Nishikawa T. Absorption of pathogenic autoantibodies by the extracellular domain of pemphigus vulgaris antigen (Dsg3) produced by baculovirus. J Clin Invest 1994;94:59-67.
Di Zenzo G, Amber KT, Sayar BS, Müller EJ, Borradori L. Immune response in pemphigus and beyond: progresses and emerging concepts. Semin Immunopathol 2016;38:57-74.
Pan M, Liu X, Zheng J. The pathogenic role of autoantibodies in pemphigus vulgaris. Clin Exp Dermatol 2011;36:703- 7.
Yan L, Wang JM, Zeng K. Association between HLA-DRB1 polymorphisms and pemphigus vulgaris: A meta-analysis. Br J Dermatol 2012;167:768-77.
Tong JC, Tan TW, Sinha AA, Ranganathan S. Prediction of desmoglein-3 peptides reveals multiple shared T-cell epitopes in HLA DR4- and DR6- associated Pemphigus vulgaris. BMC Bioinformatics 2006; 7(SUPPL.5):1-11.
Brenner S, Goldberg I. Drug-Induced Pemphigus. Clin Dermatol; 29(4):455-7;
Reis VMS, Toledo RP, Lopez A, Diaz LA, Martins JEC. UVB-induced acantholysis in endemic pemphigus foliaceus (fogo selvagem) and pemphigus vulgaris. J Am Acad Dermatol 2000;42:571-6.
Badri T, Hammami H, Lachkham A, Benmously-Mlika R, Mokhtar I, Fenniche S. Radiotherapy-induced pemphigus vulgaris with autoantibodies targeting a 110kDa epidermal antigen. Int J Dermatol 2011;50:1475-9.
Brenner S, Sasson A, Sharon O. Pemphigus and infections. Clin Dermatol 2002; 20:114-8.
Brenner S, Tur E, Shapiro J, y cols. Pemphigus vulgaris: Environmental factors. Occupational, behavioral, medical, and qualitative food frequency questionnaire. Int J Dermatol 2001;40:562-9.
Cawson RA, Odell EW. Cawson’s Essentials of Oral Pathology and Oral Medicine. Churchill Livingstone Elsevier;2008:232-34.
Sánchez-Pérez J, García-Díez A. Pénfigo. Actas Dermosifiliogr 2005;96:329-56.
Arpita R, Monica A, Venkatesh N, Atul S, Varun M. Oral Pemphigus Vulgaris: Case Report. Ethiop J Health Sci 2015;25:367- 72.
Nunes R, Moresco V, Marley G, Da Silva B, Pérez P. Pénfigo vulgar – Caso clínico. Av Odontoestomatol 2005; 21: 189-93.
Tamgadge S, Tamgadge A, Bhatt DM, Bhalerao S, Pereira T. Pemphigus vulgaris. Contemp Clin Dent 2011; 2: 134- 7.
Sociedad Española de Inmunología. Protocolos de Diagnóstico Inmunológico En Enfermedades Autoinmunes. Barcelona: Elsevier España S.L., 2014.
Martin LK, Agero AL, Werth V, Villanueva E, Segall J, Murrell DF. Interventions for pemphigus vulgaris and pemphigus foliaceus. Cochrane Database Syst Rev 2009;(1).
Zhao CY, Murrell DF. Pemphigus vulgaris: An evidence-based treatment update. Drugs 2015;75:271-84.
Lever WF. Treatment of Pemphigus Vulgaris. Arch Dermatol 1984;69:474-5.
Bystryn JC. Adjuvant Therapy of Pemphigus. Arch Dermatol 1984;120:941- 51.
Cohen SN, Lim RP, Paul CJ, Abdullah A. Equal efficacy of topical tacrolimus and clobetasone butyrate in pemphigus foliaceus. Int J Dermatology 2006;45:1379.
Pollmann R, Schmidt T, Eming R, Hertl M. Pemphigus: a Comprehensive Review on Pathogenesis, Clinical Presentation and Novel Therapeutic Approaches. Clin Rev Allergy Immunol 2018;54:1-25.
Powell AM, Albert S, Al Fares S, y cols. An evaluation of the usefulness of mycophenolate mofetil in pemphigus. Br J Dermatol 2003;149:138-45.
Chams-Davatchi C, Esmaili N, Daneshpazhooh M, y cols. Randomized controlled open-label trial of four treatment regimens for pemphigus vulgaris. J Am Acad Dermatol 2007;57:622-8.
Sharma VK, Khandpur S. Evaluation of cyclophosphamide pulse therapy as an adjuvant to oral corticosteroid in the management of pemphigus vulgaris. Clin Exp Dermatol 2013;38:659-64.
Werth VP, Fivenson D, Pandya AG, y cols. Multicenter randomized, doubleblind, placebo-controlled, clinical trial of dapsone as a glucocorticoid-sparing agent in maintenance-phase pemphigus vulgaris. Arch Dermatol 2008;144:25-32.
Gürcan HM, Razzaque Ahmed A. Analysis of current data on the use of methotrexate in the treatment of pemphigus and pemphigoid. Br J Dermatol 2009; 161:723-31.

Veneri, Nicolas
Máster en Cirugía Bucal e Implantología. Hospital Viamed Virgen de La Paloma.
Al-Nakash, Dur Bawi
Máster en Cirugía Bucal e Implantología. Hospital Viamed Virgen de La Paloma.
Martínez Rodríguez, Natalia
Profesora asociada del Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, Universidad Complutense de Madrid (UCM).
Leco Berrocal, Isabel
Profesora contratada doctora del Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, UCM.
Madrigal-Martínez Pereda, Cristina
Profesora contratada doctora del Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, UCM.
Martínez-González, José Mª
Profesor titular del Departamento de Especialidades Clínicas Odontológicas. Facultad de Odontología, UCM.