Revisión bibliográfi ca
Fraile Marcos N, Molina Ponte B. Concentrados plaquetarios para regeneración y tratamiento de tejidos duros y blandos. Cient. Dent. 2021; 18; 5; 303-310
Concentrados plaquetarios para regeneración y tratamiento de tejidos duros y blandos
Debido a la alta frecuencia de las recesiones periodontales y sus repercusiones, se planteó este estudio con el objetivo de comparar los efectos de los diferentes derivados plaquetarios utilizados en el tratamiento de lesiones en tejidos blandos y duros orales. Se realizó una búsqueda en Pubmed/ Medline, EMBASE, el Registro de Ensayos del Cochrane Oral Health Group, Lilacs de ensayos clínicos que utilicen concentrados plaquetarios para el tratamiento de defectos periodontales y periimplantarios en comparación con los tratamientos convencionales.
Los principales resultados observados no mostraron diferencias signifi cativas en ninguna de las siguientes variables: profundidad de sondaje, nivel de inserción clínico, recubrimiento radicular mediante colgajo de avance coronal y grosor de encía queratinizada. La única variable estudiada en la que se encontraron diferencias signifi cativas fue en la realización de un colgajo de acceso agregando concentrados plaquetarios y sin ellos.
Podemos concluir en este estudio que los derivados plaquetarios como el plasma rico en plaquetas (PRP), plasma rico en fi brina (PRF) y el plasma rico en fi brina y leucocitos (L-PRF) pueden ser benefi – ciosos en el tratamiento y regeneración de tejidos blandos y duros periodontales y periimplantarios. No obstante, se necesita más investigación para analizar detalladamente el comportamiento de estos derivados sanguíneos.
This study was put forward as a result of the number and consequences of periodontal recessions, this review aims to compare the effects of different types of platelet concentrates used to treat hard and soft oral tissue defects. In order to do so, clinical trials were researched based on the usage of platelet concentrates, compared with conventional treatments were searched in PubMed/Medline, EMBASE, Cochrane Oral Health Group, and Lilacs.
Within the main outcomes, there were not found remarkable differences in any of the following factors: probing depth, clinical attachment level, root coverage, coronal advance fl ap, keratinized gingival width.
There was only signifi cant distinction on the studies that compared the usage of an access fl ap variable with and without platelet concentrates.
To sum up, seems to be benefi cial the addition of platelet rich plasma (PRP), platelet rich fi brin (PRF) and leucocyte platelet rich fi brin (L-PRF) to the treatment when dealing with periodontal and periimplant defects.
Nevertheless, further investigations and studies are needed in order to be able to analyze in detail the behavior of these blood products.
La exposición de las raíces dentales como consecuencia de la migración apical del margen gingival es lo que se conoce como recesión gingival1 . Este fenómeno, de etiología multifactorial2-6, provoca en nuestros pacientes traumas, tanto estéticos como funcionales.
Hoy en día, las recesiones gingivales son uno de los problemas cotidianos más frecuentes que se encuentran en la práctica diaria, siendo más acusadas con la edad y pudiendo afectar tanto a dientes como a implantes. Pueden encontrarse en más del 50 por ciento de la población7 . Por este motivo y porque es un tema altamente estudiado, hay descritos numerosos procedimientos para su tratamiento, como los injertos de tejido conectivo (CTG), las técnicas de colgajo de avance coronal (CAF) para el recubrimiento de las raíces y la regeneración tisular guiada (GTR). Estos procedimientos se pueden combinar entre sí para aumentar su tasa de éxito o se pueden realizar en conjunto con derivados de matriz del esmalte (EMG).
Actualmente, debido a la continua evolución de las ciencias biomédicas, se ha planteado la regeneración de los tejidos blandos como tratamiento de las recesiones gingivales, llegando a ser objeto de estudio la utilización de derivados autólogos de la sangre, cuyo efecto ya había sido investigado en la promoción de una mejora de la cicatrización de los tejidos blandos. Fueron Whitman y cols.8 quienes iniciaron la utilización de los concentrados plaquetarios en el campo de la Odontología.
La utilización de factores de crecimiento como el factor de crecimiento derivado de plaquetas AB (PDFG-AB), el factor de crecimiento transformante beta 1(TGFb-1) y el factor de crecimiento endotelial vascular (VEGF), encontrados en las plaquetas, pretenden coadyuvar en la angiogénesis, la proliferación celular y la remodelación ósea. Actualmente hay una gran variedad de derivados sanguíneos autólogos; en esta revisión nos centraremos en el plasma rico en plaquetas (PRP), el plasma rico en fibrina (PRF) y el plasma rico en fibrina y leucocitos (L-PRF), que se explicarán a continuación, cuya utilización puede ser en exclusiva o en combinación con biomateriales9-10.
- PRP: después de la centrifugación es necesaria su coacción con trombina y cloruro de calcio para la adquisición de este gel de alta concentración de plaquetas. Como protocolo de actuación, se extrae sangre venosa y se mezcla con anticoagulante, se separa la sangre en 3 capas mediante el “soft spin”. Se aspira con una jeringa estéril el Plasma Pobre en Plaquetas (PPP), el PRP y, por defecto, algunos glóbulos rojos. Se centrifuga (“hard spin”) el contenido de lo anterior en un segundo tubo y como resultado se obtienen de nuevo las 3 capas y las plaquetas al fondo. Se recolecta el PRP con suaves movimientos oscilantes de la muestra para obtener el Plasma Rico en Plaquetas concentrado (cPRP). En el momento de la administración se mezcla el cPRP con trombina bovina y cloruro de calcio, obtenido un gel con una matriz de fibrina11.
- PRF: a diferencia del anterior, no es necesario su tratamiento con anticoagulantes y provee a la muestra de mayor número de glóbulos blancos y una estructura natural de fibrina. Tampoco requiere la utilización de trombina bovina12. El protocolo de obtención es un proceso más sencillo, en el que se extrae la sangre venosa y se centrifuga durante 10 minutos a 3000 rpm. Como en este caso no se emplean anticoagulantes, se libera la cascada de coagulación y las plaquetas en contacto con las paredes del tubo comienzan a activarse. En el momento en el que el fibrinógeno se convierte en fibrina, se desarrolla un coágulo de ésta en el centro del tubo separando, en la parte inferior, el plasma acelular, y los glóbulos rojos en la parte superior. El éxito de esta técnica reside en la rapidez de obtención y centrifugación de la muestra. Es posible que, debido a las citoquinas atrapadas en la red de fibrina, se observe durante la remodelación de la matriz inicial una regulación inflamatoria.
- L-PRF: esta malla de fibrina, que contiene leucocitos, factores de crecimiento, proteínas y citoquinas13, se produce sin anticoagulantes y, como el anterior, no requiere la agregación de trombina bovina14,15. Se obtiene una liberación lenta, pero esencial, de factores de crecimiento, claves para las primeras fases de cicatrización13,15-18 que, ayudados por las propiedades de la fibrina, pueden promover la regeneración del tejido19. Como protocolo, este proceso requiere la extracción de la sangre e inmediata centrifugación durante 12 minutos a 2700 rpm20, 15, 18, 21-25. Se crea un coágulo en la parte media del tubo, por la reacción de la trombina con el fibrinógeno, que separa el plasma acelular en la parte superior y los eritrocitos en la parte baja del tubo (Tabla 1).

Basándose en los estudios de Rose y cols.26 sobre el potencial regenerativo de las plaquetas, hoy en día se conoce el valor de la fibrina y los leucocitos en la regeneración de los tejidos periodontales, aunque no son muchas las publicaciones encontradas sobre la utilización de estos en recesiones gingivales y periimplantarias. El objetivo de esta revisión es el análisis del efecto de PRP, PRF, y L-PRF aisladamente y en combinación con injertos de tejido conectivo y derivados de la matriz del esmalte.
Se realizó una búsqueda en las bases de datos de Pubmed/ Medline, EMBASE, el Registro de Ensayos del Cochrane Oral Health Group y Lilacs. Como palabras clave se utilizaron: gingival recession, platelet-rich plasma, platelet-rich fibrin, soft tissue regeneration, furcation defects, periodontal healing period.
En esta revisión se excluyeron los títulos repetidos y con datos abstractos. Y se incluyeron todos aquellos ensayos clínicos aleatorios, con seguimiento mínimo de 3 meses en pacientes sin patologías y con recesiones dentales o periimplantarias.
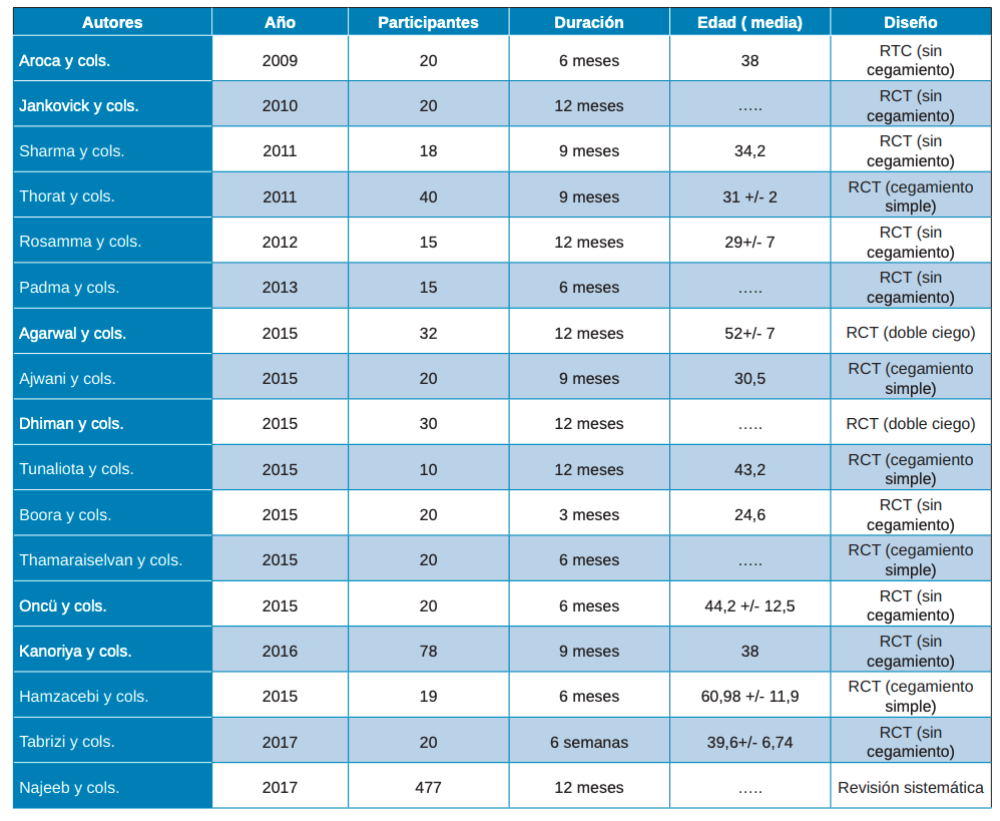
Después de analizar los artículos, 17 fueron los seleccionados como adecuados para este estudio, tras la evaluación de la calidad de CASP y PRISMA, de los que se encontraron inicialmente en la búsqueda electrónica. En todos los artículos incluidos se realizaban ensayos clínicos comparando la utilización de PRP, PRF y L-PRF en diferentes técnicas de regeneración y en técnicas convencionales. El periodo de seguimiento variaba ente 3 y 12 meses (Tabla 2).
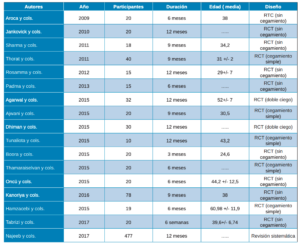
Ninguno de los autores tuvo especial interés en la descripción de los instrumentos utilizados durante las intervenciones de las técnicas convencionales, tan solo Jankovick y cols.27 que especifican el uso de las proteínas derivadas de la matriz del esmalte (Emdogain®, Straumann®). Así mismo, tampoco se brinda atención a las centrifugadoras, siendo tres las mencionadas: EBA 20, Hettich GMbH & Co KG, Tuttlingen, Alemania; RC-4, REMi, Mimbai, India; y Nüve Laboratory Equipments, NF200, Ankara, Turquía.
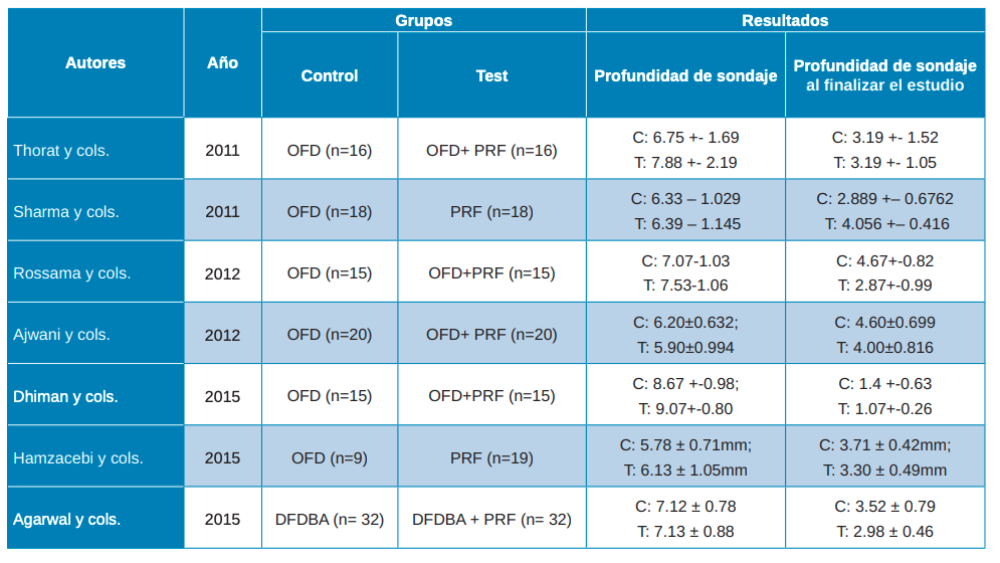
Una vez realizadas las intervenciones, como resultados primarios se analizaron la Profundidad de Sondaje (PD) y el Nivel de Inserción Clínico (CAL). La profundidad de sondaje viene definida como la distancia desde el margen gingival hasta la base del surco gingival. En los artículos de Thorat y cols.28, Rosamma y cols.29, Ajwani y cols.30, Sharma y cols.31, Dhiman y cols.32, Hamzacebi y cols.33 y Najeeb y cols.34 se encuentran resultados favorables del grupo prueba, con colgajo de acceso (OFD) + PRF, respecto al control (OFD). En un estudio se observa una mejora significativa en relación con el PRF + alendronato35. Lo mismo sucede en el estudio de Agarwal y cols.36 que muestra resultados estadísticamente significativos en el grupo de prueba (PRF/aloinjerto óseo liofilizado descalcificado -DFDBA-) (Tabla 3).
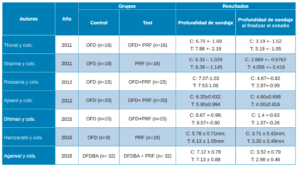
En cuanto al Nivel de Inserción Clínico (CAL), se define como la distancia desde la unión cemento-esmalte hasta la base del surco gingival. Algunos artículos no aportan datos sobre el CAL. Los artículos de Aroca y cols.37, Padma y cols.38, Rosamma y cols.29, Ajwani y cols.30, Sharma y cols.31, Dhiman y cols.32 y Hamzacebi y cols.33 muestran mejoras estadísticamente significativas favorables al grupo de prueba en sus respectivas técnicas (Tabla 4).

Como resultados secundarios se observó la Anchura de Encía Queratinizada (KGW), calculada desde la unión mucogingival hasta el margen de encía libre en el punto mediobucal. Este parámetro no se midió en 9 de los artículos incluidos en el estudio. En la mayor parte de los estudios se observan diferencias estadísticamente significativas con una ganancia de anchura de encía queratinizada respecto a los valores iniciales. El único estudio en el que se encontraron diferencias significativas en relación con el grupo de prueba fue en el de Padma y cols.38
Por último, el Recubrimiento Radicular (RC) se obtuvo mediante la formula: [Profundidad de recesión preoperatoria (distancia ente la unión amelocementaria (CEJ) y el margen gingival antes de la cirugía) – Profundidad de recesión postoperatoria (distancia entre CEJ y el margen gingival después de la cirugía) / Profundidad de recesión preoperatoria] x 100. En contraposición a la mayoría de los autores, Padma y cols.38 encontraron resultados estadísticamente significativos a favor del grupo de ensayo con CAF + PRF. Thamaraiselvan y cols.39 comparan CAF + CTG y CAF + PRF, no encontrando diferencias estadísticamente significativas, pero sí una mayor estabilidad en el tiempo del grupo de prueba.
La meta en este estudio es evaluar y comparar los diferentes agregados plaquetarios utilizados en solitario o en colaboración con técnicas de regeneración de los tejidos blandos o que utilizan derivados de la matriz del esmalte. Como ya se ha explicado anteriormente, ha habido una gran producción de diversos concentrados plaquetarios9,10 para su utilización en las recesiones gingivales y periimplantarias4,40, ya que es bien conocida la acción de los leucocitos, la fibrina y las plaquetas en la regeneración de los tejidos, que es la finalidad de la periodoncia.
Aunque hay un amplio campo de estudios sobre la beneficiosa acción de las plaquetas y factores de crecimiento en la regeneración ósea, su evaluación sobre las recesiones gingivales y tejidos periimplantarios es escasa. Por esa razón se realiza esta revisión, en la que 13 de los estudios se centran en la cobertura de recesiones gingivales en dientes y 4 en implantes. Todos los estudios fueron ensayos clínicos aleatorizados en humanos, excepto uno, que fue una revisión sistemática.
Al ordenar los datos hallados en áreas de cirugía plástica periodontal se obtiene:
- El CAF, en solitario o asociado a derivados sanguíneos, no presenta diferencias significativas en las variables estudiadas (PD, CAL, KGW o RC). Únicamente Padma y cols.38 manifiestan las mejorías en el CAL, KGW y RC con el uso de PRF bajo el CAF.
- En cuanto al CAF asociado a CTG o concentrados plaquetarios, no se encontraron diferencias significativas. Cabe destacar los resultados contrarios en los estudios de Jankovic y cols.26 que observaron una mayor ganancia de KGW en el CAF + CTG, en contraposición a Thamaraiselvan y cols.39 que encontraron mayor ganancia en el grupo CAF + PRF. Tunaliota y cols.41 únicos autores que emplean L-PRF, no hallaron diferencias significativas.
- En el estudio de OFD solo y OFD + PRF, todos los autores29-34 corroboran la mejoría en defectos óseos, de furca, PD, CAL y KGW. Solo Kanoriya y cols.35 comparan una tercera categoría, OFD + PRF + Alendronato, siendo esta la que mejores resultados obtuvo en el relleno de defectos óseos, PD y CAL.
En relación a los defectos periimplantarios, solo se encontraron 4 trabajos, siendo el PRF el concentrado plaquetario de elección para el estudio.
- En el estudio de Boora y cols.42 como punto de partida realizaron la colocación de un implante en la región anterior del maxilar superior, con provisional inmediato, no funcional. Y de manera aleatoria se dispuso el PRF. No hubo diferencias estadísticamente significativas en la PD ni en hemorragias. Concluyen que el PRF puede ser beneficioso para los tejidos periimplantarios.
- Oncu y cols.43 buscaban comparar, mediante cálculo de la frecuencia de resonancia en el momento de la colocación de los implantes, a la semana y al primer mes, la estabilidad de estos asociados o no a PRF. Concluyeron con la observación de una mayor estabilidad en el período de cicatrización temprana en aquellos en los que se dispuso PRF.
- En el estudio de Hamzacebi y cols.33 se examina la pérdida ósea periimplantaria comparando el uso de PRF frente a la cirugía con colgajo de acceso. El grupo prueba (PRF) presentó mayor ganancia de CAL, menor PD y a los 6 meses mayor KGW.
- Tabrizi y cols.44 encontraron un aumento en los valores del cociente de la estabilidad del implante (ISQ) en la parte posterior del maxilar después de 2, 4 y 6 semanas.
Después de realizar la evaluación de los estudios se encuentran algunas limitaciones a constatar, como la presencia de algunos ensayos de riesgo de sesgo moderado, además de la diversidad de metodologías utilizadas por los autores y las limitadas publicaciones con relación a tejidos periimplantarios. A pesar de las limitaciones de este estudio, cabe destacar los posibles beneficios del uso de concentrados plaquetarios en la practica clínica, ya que los autores no encontraron diferencias estadísticamente significativas entre ellos y las técnicas convencionales. Por ello, hay que destacar la gran utilidad de estos compuestos, al reducir la morbilidad y el coste de los tratamientos. No obstante, se necesitan más estudios para corroborar su rentabilidad y estabilidad en el tiempo.
- La utilización de derivados sanguíneos autólogos sobre la recesiones gingivales y periimplantarias parece ser beneficiosa.
- Con relación al colgajo de acceso, se obtuvieron mejores resultados en la profundidad de sondaje, el nivel clínico de inserción, la anchura de encía queratinizada y el recubrimiento radicular utilizando plasma rico en plaquetas (PRP), plasma rico en fibrina (PRF) y el plasma rico en fibrina y leucocitos (L-PRF).
- Respecto a la anchura de encía queratinizada, se obtuvieron mejores resultados con injertos de tejido conectivo.
- Se necesitan más estudios de comparación de los diferentes derivados sanguíneos autólogos.
Merijohn, G. Managenement and prevention of gingival recession. Periodontology 2000. 2016 (71): 228 – 242.
Trott JR, Love B. An analysis of localized gingival recession in 766 Winnipeg High School students. Dent Pract Dent Rec. 1966;16(6):209-213.
Gorman WJ. Prevalence and etiology of gingival recession. J Periodontol. 1967;38(4): 316-322
Bernimoulin J, Curilovie Z. Gingival recession and tooth mobility. J Clin Periodontol. 1977.(2):107-114.
Lost C. Depth of alveolar bone dehiscences in relation to gingival recessions. J Clin Periodontol. 1984;11(9):583-589.
Aravind Kumar P. BF, Surya C. Platelet rich fibrin: A promising approach for root coverage. J Interdiscio Dentistry. 2011(2): 115-118.
Kassab MM, Cohen RE. The etiology and prevalence of gingival recession. J Am Dent Assoc. 2003;134(2):220-225.
Whitman DH, Berry RL, Green DM. Platelet gel: an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J Oral Maxillofac Surg. 1997;55(11):1294-1299.
Baeyens W, Glineur R, Evrard L. The use of platelet concentrates: plateletrich plasma (PRP) and platelet-rich fibrin (PRF) in bone reconstruction prior to dental implant surgery. Rev Med Brux. 2010(6):5211-5217.
Inchingolo F, Tatullo M, Marrelli M, Inchingolo AM, Scacco S, Inchingolo AD, y cols. Trial with Platelet-Rich Fibrin and Bio-Oss used as grafting materials in the treatment of the severe maxillar bone atrophy: clinical and radiological evaluations. Eur Rev Med Pharmacol Sci. 2010;14(12): 1075-1084.
Dohan Ehrenfest DM, Rasmusson L, Albrektsson T. Classification of platelet concentrates: from pure Platelet-Rich Plasma (P-PRP) to Leucocyte-and Platelet-Rich Fibrin (L-PRF). Trends Biotechnol. 2009;27(3):158-167.
Sunitha Raja V, Munirathnam Naidu E. Platelet-rich fibrin: evolution of a secondgeneration platelet concentrate. Indian J Dent Res. 2008;19(1):42-46.
Choukroun J, Diss A, Simonpieri A, Girard MO, Schoeffler C, Dohan SL, y cols. Platelet-Rich Fibrin (PRF): a secondgeneration platelet concentrate. Part IV: clinical effects on tissue healing. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101(3):56-60.
Dohan Ehrenfest DM, Del Corso M, Diss A, Mouhyi J, Charrier JB. Threedimensional architecture and cell composition of a Choukroun’s platelet-rich fibrin clot and membrane. J Periodontol. 2010;81(4):546-555.
Dohan Ehrenfest DM, Diss A, Odin G, Doglioli P, Hippolyte MP, Charrier JB. In vitro effects of Choukroun’s PRF (plateletrich fibrin) on human gingival fibroblasts, dermal prekeratinocytes, preadipocytes, and maxillofacial osteoblasts in primary cultures. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009;108(3):341-352.
Fontana S, Olmedo DG, Linares JA, Guglielmotti MB, Crosa ME. Effect of platelet-rich plasma on the peri-implant bone response: an experimental study. Implant Dent. 2004;13(1):73-78.
He L, Lin Y, Hu X, Zhang Y, Wu H. A comparative study of Platelet-Rich Fibrin (PRF) and Platelet-Rich Plasma (PRP) on the effect of proliferation and differentiation of rat osteoblasts in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009;108(5):707-713.
Dohan Ehrenfest DM, Bielecki T, Jimbo R, Barbe G, Del Corso M, Inchingolo F, y cols. Do the fibrin architecture and leukocyte content influence the growth factor release of platelet concentrates? An evidence-based answer comparing a pure platelet-rich plasma (P-PRP) gel and a leukocyte- and platelet-rich fibrin (L-PRF). Curr Pharm Biotechnol. 2012;13(7):1145-1152.
Simonpieri A, Del Corso M, Vervelle A, Jimbo R, Inchingolo F, Sammartino G, y cols. Current knowledge and perspectives for the use of platelet-rich plasma (PRP) and platelet-rich fibrin (PRF) in oral and maxillofacial surgery part 2: Bone graft, implant and reconstructive surgery. Curr Pharm Biotechnol. 2012;13(7):1231- 1256.
Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, y cols. Platelet-rich fibrin (PRF): a secondgeneration platelet concentrate. Part III: leucocyte activation: a new feature for platelet concentrates? Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101(3):51-55.
Mazor Z, Horowitz RA, Del Corso M, Prasad HS, Rohrer MD, Dohan Ehrenfest DM. Sinus floor augmentation with simultaneous implant placement using Choukroun’s platelet-rich fibrin as the sole grafting material: a radiologic and histologic study at 6 months. J Periodontol. 2009;80(12): 2056-2064.
Sammartino G, Dohan Ehrenfest DM, Carile F, Tia M, Bucci P. Prevention of hemorrhagic complications after dental extractions into open heart surgery patients under anticoagulant therapy: the use of leukocyte- and platelet-rich fibrin. J Oral Implantol. 2011;37(6):681-690.
Kobayashi M, Kawase T, Horimizu M, Okuda K, Wolff LF, Yoshie H. A proposed protocol for the standardized preparation of PRF membranes for clinical use. Biologicals. 2012;40(5):323-329.
Sclafani AP, Saman M. Platelet-rich fibrin matrix for facial plastic surgery. Facial Plast Surg Clin North Am. 2012;20(2):177- 186.
Li Q, Pan S, Dangaria SJ, Gopinathan G, Kolokythas A, Chu S, y cols. Platelet-rich fibrin promotes periodontal regeneration and enhances alveolar bone augmentation. Biomed Res Int.2013 :638043.
Rose JC, Johnson M, Ramwell PW, Kot PA. Effects of arachidonic acid on systemic arterial pressure, myocardial contractility and platelets in the dog. Proc Soc Exp Biol Med. 1974: 47(3):652-655.
Jankovick S, Aleksic Z, Milinkovic I, Dimitrijevic B. The coronally advanced flap in combination with platelet-rich fibrin (PRF) and enamel matrix derivative in the treatment of gingival recession: a comparative study. Eur J Esthet Dent. 2010;5(3):260-273.
Thorat M, Pradeep AR, Pallavi B. Clinical effect of autologous platelet-rich fibrin in the treatment of intra-bony defects: a controlled clinical trial. J Clin Periodontol. 2011;38(10):925-932.
Rosamma Joseph V, Raghunath A, Sharma N. Clinical effectiveness of autologous platelet rich fibrin in the management of infrabony periodontal defects. Singapore Dent J. 2012;33(1):5- 12.
Ajwani H, Shetty S, Gopalakrishnan D, Kathariya R, Kulloli A, Dolas RS, y cols. Comparative evaluation of plateletrich fibrin biomaterial and open flap debridement in the treatment of two and three wall intrabony defects. J Int Oral Health. 2015;7(4):32-37.
Sharma A, Pradeep AR. Autologous platelet-rich fibrin in the treatment of mandibular degree II furcation defects: a randomized clinical trial. J Periodontol. 2011;82(10):1396-403.
Dhiman M, Kumar S, Duhan J, Sangwan P, Tewari S. Effect of platelet-rich fibrin on healing of apicomarginal defects: a randomized controlled trial. J Endod. 2015;41(7):985-991.
Hamzacebi B, Oduncuoglu B, Alaaddinoglu EE. Treatment of periimplant bone defects with platelet-rich fibrin. Int J Periodontics Restorative Dent. 2015;35(3):415-422.
Najeeb y cols. Regenerative potential of Platelet Rich Fibrin (PRF) for curing intrabony periodontal defects: A systematic review of clinical studies. Tissue Eng Regen Med. 2017, (14):735– 742.
Kanoriya D, Singhal S, Garg V, Pradeep AR, Garg S, Kumar A. Clinical efficacy of subgingivally-delivered 0.75% boric acid gel as an adjunct to mechanotherapy in chronic periodontitis: A randomized, controlled clinical trial. J Investig Clin Dent. 2019; 9(1).
Agarwal A, Gupta ND, Jain A. Platelet rich fibrin combined with decalcified freezedried bone allograft for the treatment of human intrabony periodontal defects: a randomized split mouth clinical trial. Acta Odontol Scand. 2016;74(1):36-43.
Aroca S, Barbieri B, Istvan G, Etienne D. Clinical evaluation of a modified coronally advanced flap alone or in combination with a platelet-rich fibrin membrane for the treatment of adjacent multiple gingival recessions: A 6-month dtudy. J Periodontol.2009; 80(2): 244-252.
Padma R, Shilpa A, Kumar PA, Nagasri M, Kumar C, Sreedhar A. A split mouth randomized controlled study to evaluate the adjunctive effect of platelet-rich fibrin to coronally advanced flap in Miller’s class-I and II recession defects. J Indian Soc Periodontol. 2013;17(5):631-636.
Thamaraiselvan M, Elavarasu S, Thangakumaran S, Gadagi JS, Arthie T. Comparative clinical evaluation of coronally advanced flap with or without platelet rich fibrin membrane in the treatment of isolated gingival recession. J Indian Soc Periodontol. 2015;19(1):66- 71.
Jung J, Ahn YJ, Kang LW. A novel approach to investigating protein/protein interactions and their functions by TAPtagged yeast strains and its application to examine yeast transcription machinery. J Microbiol Biotechnol. 2008;18(4):631- 638.
Tunaliota M, Ozdemir H, Arabaciota T, Gurbuzer B, Pikdoken L, Fiatli E. Clinical evaluation of autologous platelet-rich fibrin in the treatment of multiple adjacent gingival recession defects: a 12-month study. Int J Periodontics Restorative Dent. 2015;35(1):105-114
Boora P, Rathee M, Bhoria M. Effect of Platelet Rich Fibrin (PRF) on peri-implant soft tissue and crestal bone in onestage implant placement: A randomized controlled trial. J Clin Diagn Res. 2015;9(4):18-21.
Oncu E, Alaaddinoglu EE. The effect of platelet-rich fibrin on implant stability. Int J Oral Maxillofac Implants. 2015;30(3):578- 582.
Tabrizi, R, Arabion, H, Karagah, T. Does platelet‐rich fibrin in‐ crease the stability of implants in the posterior of the maxilla? A split‐mouth randomized clinical trial. Int. J. Oral Maxillofac. Sure.2017; (47): 672– 675.

Fraile Marcos, Natalia
DDS. Graduada en Odontología por la Universidad de Oviedo (UNIOVI).
Molina Ponte, Bárbara
DDS, MS, PhD. Graduada en Odontología por la Universidad Complutense de Madrid (UCM), Máster Universitario en Implantología Oral Avanzada (UEM), Doctorado en Ciencias Biomédicas y Ciencias de la Salud (UEM), Profesora del Máster Universitario en Cirugía e Implantología Bucal Avanzada (UEM).