Puesta al día
Xiang Zhou L, Rojo López, R, Herrera Ureña L, Cidoncha Cabrerizo G, Prados Frutos JC. Colutorios para el tratamiento de la halitosis intraoral: actualización y puesta al día. Cient. Dent. 2022; 19; 1; 49-56
Colutorios para el tratamiento de la halitosis intraoral: actualización y puesta al día
Antecedentes: En la sociedad actual, la halitosis es motivo de preocupación creciente de los pacientes, los cuales demandan a sus profesionales soluciones terapéuticas para el tratamiento de esta entidad de etiología multifactorial. Los compuestos sulfurados volátiles, originados, fundamentalmente, por las bacterias anaerobias gram negativas de la microbiota oral, son los principales responsables de mal olor oral.
Objetivo: Realizar una revisión y actualización de la evidencia científica respecto a los principales componentes activos de los enjuagues orales empleados para el tratamiento de la halitosis intraoral.
Material y método: Se realizó una búsqueda bibliográfica en las bases de datos: Medline/PubMed, Cochrane Library, Scopus y Web of Science empleando los términos de búsqueda: Halitosis AND mouthwash OR mouthrinse hasta Julio del 2021.
Resultados y discusión: Los colutorios se han propuesto en múltiples publicaciones como tratamiento para combatir la halitosis. Su capacidad para acceder a las áreas menos accesibles de la cavidad oral, la buena aceptación por parte de los pacientes gracias a su facilidad de utilización y la sensación de frescor y limpieza tras su uso, han hecho que su empleo esté ampliamente extendido. Compuestos como la clorhexidina, el cloruro de cetilpiridino, la octenidina, el triclosán o las sales metálicas persiguen, mediante diferentes mecanismos de acción, la mejora del aliento.
Conclusión: La eficacia de los colutorios para el tratamiento de la halitosis dependerá del tipo de principio activo, o la combinación de ellos, de la formulación, así como, de la realización de un correcto diagnóstico etiológico.
Background: In today’s society, halitosis is a growing concern of patients, who demand therapeutic solutions from their professionals for the treatment of this multifactorial condition. Volatile sulfur compounds, mainly caused by gramnegative anaerobic bacteria of the oral microbiota, are the responsibles for the genesis of oral malodour.
Objective: The objective of this article is to review and update the scientific evidence regarding the main active components of mouthrinses used for the treatment of intraoral halitosis.
Material and method: To fulfill the objective of this review, a bibliographic search was carried out in the main electronic databases: Pudmed / Medline, Cochrane Library, Scopus and Web of Science using the search terms: Halitosis AND mouthwash OR mouthrinse up to July 2021.
Results and discussion: Mouthwashes have been proposed in multiple publications as a treatment to control halitosis. Due to its ability to reach the less accessible areas of the oral cavity, the good acceptance by patients, its ease of application, the feeling of freshness, and cleanliness after use, its use has extended widely. Compounds such as chlorhexidine, cetylpyridine chloride (CPC), octenidine, triclosan or metal salts, through different mechanisms of action, seek to improve breath.
Conclusion: The efficacy of mouthwashes for the treatment of halitosis will depend on the type of active ingredient, or the combination of them, on the formulation, as well as on the realization of a correct etiological diagnosis.
La halitosis se define como la existencia de olores desagradables u ofensivos que emanan de la cavidad bucal1 , pudiendo considerarse simultáneamente como un síntoma y signo. En este sentido, una reciente investigación, sugiere que la autopercepción de mal olor oral referido por el paciente podría ser útil como un primer screening diagnóstico de halitosis previo al realizado en la consulta2 . La prevalencia estimada varía en función de la edad poblacional, siendo aproximadamente de un 25% en la población adulta3 , un 40,9% en niños4 y 46,8 en ancianos5 . Alrededor del 90% de las halitosis se deben a causas intraorales, siendo el cubrimiento lingual el factor causal más importante1 . Los gases odoríficos responsables de la halitosis son producto de la interacción entre las bacterias gram negativas anaerobias de la cavidad oral y residuos de comida en dorso lingual y localizaciones periodontales. En este sentido, Ren y cols. 6 compararon el microbioma lingual de 170 niños, encontrando mayor diversidad de especies en aquellos que presentaban halitosis frente a los controles. Por ello, entre los objetivos de tratamiento de la misma se debe controlar la patología oral (enfermedad periodontal de forma particular) y otras posibles patologías y medidas de higiene oral completa incluyendo espacios interdentales.
Los principales responsables del mal aliento, además de otros gases, son los compuestos sulfurados volátiles (CSV). Entre ellos, el sulfuro de hidrógeno y el metil mercaptano son los más correlacionados con las causas orales7 , mientras que el dimetil sulfuro está más ligado a las halitosis de causa extraoral, mediadas por sangre8 .
Las opciones terapéuticas más empleadas se basan en el control de las bacterias productoras de compuestos sulfurados volátiles y la neutralización de los mismos, mediante el empleo de técnicas de abordaje mecánico o químico. Las intervenciones mecánicas (cepillado dental, higiene interproximal, raspador lingual) buscan reducir la cantidad de bacterias y sus sustratos proteicos (placa bacteriana y restos celulares descamados de la lengua y la encía), los cuales, intervienen activamente en la síntesis de los CSV9 . Al ser considerado el dorso lingual la principal fuente de halitosis intraoral numerosas investigaciones apuntan a que el raspado de esa superficie y la disminución de su carga bacteriana puede mejorar la calidad del aliento10. En relación con ello, los resultados del estudio de Dwivedi y cols.11 sugieren que el empleo de un raspador lingual plástico promueve los mayores índices de reducción del cubrimiento lingual en comparación con los metálicos y los de cerdas. No obstante, otras investigaciones sugieren que el raspado lingual tiene beneficios limitados y cortos en el tiempo para el control de la halitosis12.
Con el objetivo de subsanar las limitaciones de las terapias mecánicas y actuar sobre los nichos bacterianos de las áreas menos accesibles de la cavidad oral, se han propuesto terapias químicas como coadyuvantes a las opciones mecánicas. La gran aceptación social de los colutorios, su capacidad para actuar sobre las áreas menos accesibles de la cavidad oral y su facilidad de utilización han logrado que exista una gran variedad de propuestas en el mercado de estos productos. Por ello, el objetivo de esta revisión es realizar una puesta al día de las propiedades y características de los principales principios activos presentes en los enjuagues bucales propuestos para el tratamiento de la halitosis.
Se llevó a cabo una búsqueda en las bases de datos: Medline/PubMed, Cochrane Library, Scopus y Web of Science utilizando la siguiente estrategia de búsqueda: “Halitosis AND mouthwash OR mouthrinse”. Los criterios de inclusión fueron: publicaciones relacionadas con colutorios para el tratamiento de la halitosis, realizadas desde Enero 2001 hasta julio del 2021, artículos en inglés, español y chino. De la búsqueda se hallaron 347 referencias de las cuales, se eliminaron duplicados, se revisó el título y el resumen para valorar su relación con el objetivo de esta revisión y se descartaron aquellos que no cumplieron con los criterios de inclusión. Finalmente, 20 fueron los estudios seleccionados para la lectura completa, a partir de los cuales se ha realizado esta revisión.
Los resultados obtenidos de la búsqueda bibliográfica sugieren que las formulaciones comerciales destinadas a tratar la halitosis promueven su reducción fundamentalmente mediante dos vías:
- Reducción de la carga microbiana. Casi la totalidad de los compuestos comerciales destinados a tratar la halitosis presentan agentes antimicrobianos para controlar el biofilm bacteriano responsable del mal olor intraoral. Las principales bacterias implicadas en la génesis de la halitosis (P. gingivalis, Actinomyces, P. intermedia/nigrescens, F. nucleatum, T. denticola, B. forsytus, especies de eubacterias, selenomonas y espiroquetas) juegan también un papel destacado en el desarrollo de las enfermedades periodontales como gingivitis o periodontitis13. Por tanto, antisépticos ampliamente empleados para el manejo terapéutico de las enfermedades periodontales como la clorhexidina (CHX), el cloruro de cetilpiridinio (CPC) o el triclosán, también pueden ser útiles para tratar la halitosis.
- Conversión de los CSV en no odoríficos (neutralizadores del olor). Se trata de una serie de compuestos capaces de actuar químicamente sobre los CSV inhibiendo su volatilidad y olor. Agentes como los iones metálicos y el dióxido de cloro pueden incluirse en este apartado.
AGENTES PARA LA REDUCCIÓN DE LA CARGA MICROBIANA (ANTIMICROBIANOS)
El empleo de agentes antimicrobianos en conjunción con las terapias mecánicas es considerado el gold estándar para el manejo terapéutico de la halitosis y se encuentra ampliamente apoyado en la literatura científica. El empleo de enjuagues orales para la reducción de la halitosis intraoral ha demostrado ser efectivo independientemente del control de placa mecánico en sujetos periodontalmente sanos14. Ello es debido, fundamentalmente, al antimicrobiano presente en la mayoría de las formulaciones comerciales de los enjuagues. En este sentido, los agentes más comunes para el control bacteriano de la halitosis son los siguientes:
Clorhexidina (CHX):
Se trata del antiséptico mayoritariamente presente en los compuestos comerciales. La molécula de CHX es una bisguanida cuya presentación más común, por su estabilidad y solubilidad en agua, es en forma de sal de digluconato. Actúa sobre la membrana celular de las bacterias aumentando su permeabilidad y permitiendo la liberación de componentes intracelulares. En bajas concentraciones su efecto es bacteriostático (mediante la expulsión de productos intracelulares como el potasio y el fósforo), mientras que en concentraciones altas es bactericida (se produce la precipitación de contenido citoplasmático bacteriano). Las concentraciones comerciales de clorhexidina empleadas para el manejo de la halitosis varían desde 0,05% hasta 0,2% (en combinación con otros antimicrobianos).
Las bacterias Gram negativas son las principales productoras de sulfuro de hidrógeno y metil mercaptano. La clorhexidina es eficaz frente a las Gram negativas y las Gram positivas además de hongos y levaduras.
La clorhexidina se ha utilizado en numerosos estudios, sola o combinada, para el tratamiento químico de la halitosis. La combinación de CHX con cloruro de cetilpiridinio (CPC) ha demostrado ser de gran efectividad para la reducción de las bacterias orales implicadas en la génesis de los CSV15. Igualmente la adición de la molécula de zinc (Zn) a los efectos antimicrobianos de la clorhexidina ha reportado grandes beneficios para el control inmediato del mal olor oral16. En este sentido, Slot y cols.17, en su revisión sistemática, han hallado múltiples evidencias en los estudios revisados de la eficacia del efecto sinérgico de CHX, CPC y Zn para combatir la halitosis.
El efecto adverso más común por el empleo de la CHX es la pigmentación de los dientes, materiales de restauración, mucosas orales y dorso lingual. Los estudios apuntan a que las tinciones son dependientes de la duración y de la concentración de CHX y podrían deberse a la interacción entre las sales de clorhexidina en boca y los taninos presentes en algunos alimentos (vino, té, colorantes alimenticios, etc.)18. Otros estudios han reportado efectos de hipersensibilidad de contacto tipo mucositis, asma o incluso shock anafiláctico19.
Aceites esenciales
Se trata de una serie de compuestos procedentes del metabolismo de algunos vegetales, cuyos efectos antimicrobianos sobre la placa bacteriana y la gingivitis se han reportado en diversos estudios, por lo cual, se ha extendido su uso para el control de la halitosis. El más conocido de ellos es Listerine® consistente en una mezcla de varios aceites (timol, mentol y eucaliptol), el cual ha demostrado ser eficaz para tratar el mal olor oral, fundamentalmente a corto plazo (1/2, 1 y 3 horas), frente a placebo en el estudio de Pitts y cols.20.
Entre sus efectos adversos podemos destacar su fuerte sabor, posible capacidad erosiva sobre el esmalte dental y tinciones dentarias. West y cols.21 observaron en su ensayo clínico que los aceites esenciales producían más tinciones que el control. Sin embargo, en el mismo trabajo se apunta a que estas tinciones son fácilmente eliminadas tras una limpieza profesional.
Cloruro de cetilpiridinio (CPC)
Se trata de un compuesto de amonio cuaternario que ha demostrado in vitro reducir la placa dental hasta en un 35%. En el estudio de Silva y cols.22, con 110 sujetos, demostraron los efectos prolongados anti placa y anti gingivitis de un colutorio comercial con 0,05% de CPC a las 12 horas de su empleo. Su mecanismo de acción se basa en aumentar la permeabilidad de la pared bacteriana, favoreciendo su lisis y, consecuentemente, una disminución de la capacidad de las bacterias de adherirse a la superficie dentaria. No obstante, su eficacia puede ser menor que la de otros antisépticos basados en clorhexidina puesto que tiene menor sustantividad (propiedad que valora el tiempo en que persisten los efectos antimicrobianos de un antiséptico una vez cesado su empleo) que ésta, eliminándose antes de los tejidos orales23.
Recientemente, con motivo de la pandemia mundial por la irrupción del virus SARS-CoV-2, que ha provocado la enfermedad del COVID-19, diversas investigaciones han sugerido las propiedades virucidas del CPC, lo cual ha conllevado su adición en colutorios y sprays con el fin de combatir el SARS-CoV-2 y reducir su trasmisión. En este sentido, Popking y cols.24 determinaron que el CPC era capaz de exhibir un potente y rápido efecto, in vitro e in vivo, contra el virus influenza por su capacidad para destruir la cápsula viral y su acción lisosomotrópica; y otros autores sugieren que estos efectos virucidas pudieran ser extensivos a otros virus encapsulados como los coronavirus25. El CPC se formula en pasta y colutorios en concentraciones de 0,02-0.05%, especialmente en combinación con otros antisépticos por su efecto sinérgico. A este respecto, existe una importante dependencia entre la concentración de su formulación y su eficacia clínica.
Triclosán
Se trata de un potente antimicrobiano que debe sus efectos a su capacidad para bloquear la síntesis lipídica en las bacterias susceptibles26. Su nombre es un acrónimo del compuesto químico 2,4,4’-tricloro-2’-hidroxidifenil éter que ha sido muy empleado en la formulación de pasta dental y colutorios por su amplio espectro antimicrobiano. Es insoluble en agua y por tanto debe ir en solventes o detergentes orgánicos para que desarrolle su biodisponibilidad. Es sabido la importancia de un adecuado solvente para que el triclosán exhiba sus efectos antimicrobianos y antiinflamatorios, ya que de no darse esa circunstancia éstas propiedades pueden perderse27. El lauril sulfato sódico es el solvente más habitual con el que se formula el triclosán.
Por otro lado, el triclosán ha demostrado una marcada y prolongada actividad anti CSV en el experimento de Young y cols.28 en el cual se observaron valores significativos de reducción tanto de sulfuro de hidrógeno como de metil mercaptano, utilizando como solvente una mezcla de lauril sulfato sódico, glicol propileno y agua. En el mismo estudio refieren que los solventes oleosos, tipo aceite de oliva, son inadecuados para el triclosán y pueden inhibir sus propiedades anti CSV, los cuales parecen soportarse por sus efectos antimicrobianos.
Actualmente, su empleo está siendo muy controvertido puesto que recientes estudios en ratones apuntan al triclosán como un posible agente neurotóxico, que puede migrar al cerebro y a los tejidos animales pudiendo causar efectos adversos en órganos diana29. En este sentido, la Agencia Americana de Alimentos y Medicamentos (FDA) ha recomendado a los consumidores no emplear productos que contengan triclosán debido a la insuficiente evidencia que existe sobre su seguridad.
Octenidina
La eficacia antiséptica de la octenidina ha sido contrastada en múltiples estudios in vitro e in vivo desde los años 80 hasta ahora, siendo propuesta como una alternativa terapéutica a tener en cuenta a los productos basados en clorhexidina. El principal inconveniente encontrado para su empleo en enjuagues es su acusado sabor amargo, el cual se pretende camuflar mediante la adicción de aceites enmascarantes.
Una reciente publicación ha evaluado el empleo de productos basados en la combinación de octenidina y cloruro de zinc, como coadyuvante al tratamiento de la halitosis intraoral, obteniéndose resultados significativos para el control de la halitosis en la escala organoléptica y niveles de sulfuro de hidrógeno30.
NEUTRALIZADORES DEL OLOR
Son aquellos agentes (generalmente iones metálicos y agentes oxidativos) que mejoran el mal olor intraoral mediante la neutralización de los propios CSV o bien los compuestos precursores de éstos. Los iones metálicos como el zinc, el magnesio, el estaño, interaccionan con los sulfurados directamente convirtiéndolos en no volátiles e insolubles. El mecanismo de acción es debido a que los iones metálicos tienen afinidad por el grupo tiol de los compuestos sulfurados, se adhieren a éstos y los transforman en compuestos no odoríficos. Los agentes oxidantes, como el dióxido de cloro, actúan oxidando los aminoácidos precursores de los CSV y por ende, disminuyen la concentración de éstos.
Sales metálicas
Zinc
Las sales de zinc son ampliamente empleadas en la industria farmacológica para la formulación de pastas y colutorios, unido generalmente, con otros compuestos antimicrobianos. La combinación de zinc, clorhexidina y CPC ha demostrado tener un efecto sinérgico, siendo el que mejor calidad de evidencia presenta en cuanto a su eficacia como tratamiento de la halitosis intraoral, según la revisión sistemática de Blom y cols.31.
El mecanismo de acción por el cual el catión zinc actúa sobre los CSV es doble:
- Tiene afinidad por los grupos tioles de los CSV y se une a ellos transformando los CSV en no odoríficos, y por tanto, neutralizándolos de manera inmediata16.
- Algunos estudios han sugerido que tiene efectos antimicrobianos directos sobre el crecimiento bacteriano; concretamente inhibe el catabolismo de F. nucleatum y P. intermedia y la producción de ácidos de S. sobrinus y S. salivarius32.
El rango de concentración a las que se formula el zinc varía desde 0,14 hasta 0,4%, demostrando dichas concentraciones ser eficaces para la neutralización de sulfuro de hidrógeno in vitro. Sin embargo, el efecto sinérgico del Zn en combinación con otros agentes antisépticos como la CHX y el CPC, permite que cada uno de los componentes sea formulado en menor concentración sin repercutir en su eficacia, o incluso aumentándola y, por consiguiente, disminuyendo sus efectos secundarios. En este sentido, una combinación de 0,3% de acetato de zinc con 0,025% de clorhexidina ha demostrado tener un gran efecto anti CSV16.
En cuanto a los efectos colaterales descritos por el empleo habitual de colutorios que contienen zinc, son las tinciones dentarias y de mucosas y la alteración del sentido del gusto. No obstante, estos inconvenientes pueden ser solventados mediante el uso de menores concentraciones de zinc (en combinación de otros compuestos) y la adición de saborizantes a las formulaciones comerciales33.
Estaño
Waller y cols.34 llevaron a cabo un estudio en el que 10 sujetos realizaron enjuagues con fluoruro de estaño, encontrándose una diferencia significativa, con respecto al control, en su afinidad por los sulfurados. No obstante, los resultados de otros estudios no son concluyentes con respecto a la eficacia de los productos que contenían estaño. El grupo de Quirynen y cols.35 observaron que el empleo de un colutorio con contenido en fluoruro de amina y fluoruro de estaño sólo mostraba cambios menores en los niveles de CSV, en comparación con otros colutorios de clorhexidina, en sujetos con halitosis matinal.
Cobre
Con efectos inhibitorios de CSV similares al zinc, es ligeramente más tóxico que éste. No obstante, se cree que los propios mecanismos de homeostasis corporal podrían mantener en cero los niveles de cobre, si se emplean las dosis indicadas para fines profilácticos36. Young y cols.37 sugieren que los iones de cobre podrían ser más útiles que el zinc o el estaño para determinadas aplicaciones. De hecho, un antiguo tratamiento para el control de la enfermedad periodontal consistía en la introducción de cristales de CuSO4 en las bolsas periodontales. Además, las tabletas comerciales de Ascoxal TR (Astra, Suecia) contienen cobre en su composición, debiéndose seguramente a ello sus efectos anti halitosis37.
Dióxido de cloro
El dióxido de cloro está presente en varios agentes comerciales (spray y colutorios) dado que ha demostrado ser un potente principio activo capaz de actuar oxidando a los aminoácidos metionina y cisteína, precursores de los CSV. Además el ion cloro ha reflejado importantes efectos bactericidas en diversos estudios38.
Kim y cols 39, en su estudio sobre el mecanismo de acción de los compuestos anti CSV, observaron que el dióxido de cloro era el que presentaba efectos antihalitosis de manera más rápida e inmediata, puesto que interaccionaba directamente con los CSV preexistentes neutralizándolos.
Peróxido de hidrógeno
Los productos comerciales con este activo son capaces de unirse a los grupos tioles de la saliva (precursores de los CSV) oxidándolos y produciendo un efecto antihalitosis inmediato. Por otro lado, el peróxido de hidrógeno es un potente agente oxidante capaz de tener efecto bactericida per se, incluso sobre especies saprófitas aerobias40.
En un estudio reciente llevado a cabo por Sharma y cols.41, se comparó la eficacia de un nuevo colutorio con extracto de Ocimun Sanctum (una pequeña planta) con peróxido de hidrógeno (1,5%) y clorhexidina (0,2%) en 45 sujetos. Los resultados fueron que el peróxido de hidrógeno y la clorhexidina redujeron significativamente los niveles de CVS, índices organolépticos así como índices de placa y gingivales, evaluado tras 15 días de su aplicación. Algunos los efectos adversos descritos del empleo de este activo pueden ser alteraciones en la mucosa oral40.
Con motivo de los recientes acontecimientos originados por el coronavirus 2 (SARS-CoV-2) numerosos medios han apuntado a la posible eficacia de los enjuagues de peróxido de hidrógeno la 1% previo al inicio de los procedimientos orales para la disminución de la carga viral en saliva. No obstante, una reciente revisión sistemática al respecto ha concluido que, no existe aval científico sobre su eficacia para el control de la carga viral del SARSCoV-2, ni de otros virus, en saliva42.
Existen múltiples opciones terapéuticas en el mercado de colutorios, basados en diferentes compuestos, para el control de la halitosis (Tabla). El gold estándar, como antiséptico, sigue siendo los colutorios basados en clorhexidina en distintas concentraciones. Las revisiones de Cochrane Federowicz y cols.9 y Kumbargere y cols.43 sugieren que la terapia química que mejor perfil de evidencia muestra es la combinación de las propiedades antisépticas de la clorhexidina (0,2-0,12%) con el efecto neutralizador del cloruro de cetilpiridinio (0,05-0,07%), cuyo resultado es un efecto sinérgico muy eficaz en la inhibición de los CSV. No obstante, otras opciones terapéuticas también han de tenerse en cuenta; aquellos enjuagues cuyos activos sean aceites esenciales, dióxido de cloro, o la reciente octenidina, pueden actuar de coadyuvantes para el tratamiento de la halitosis, solos o formulados con otros compuestos.
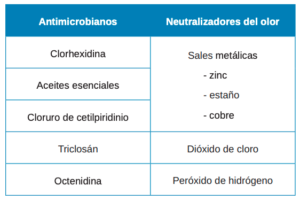
En relación con los neutralizadores del olor, las sales metálicas, en especial las de zinc, son las más empleadas en los enjuagues para tratar la halitosis. Numerosos estudios han reportado el buen comportamiento del zinc en la neutralización de los CSV, siendo capaz de unirse a los compuestos volátiles y transformándolos en no odoríficos16. Por otro lado, algunas publicaciones han sugerido que la molécula de zinc puede presentar propiedades antisépticas per se in vitro e in vivo32, aunque este aspecto es controvertido y requiere más investigación al respecto.
El auge en el empleo de ingredientes con propiedades antibacterianas de origen natural también se ha extendido al ámbito de la halitosis. Activos basados en las catequinas del té verde, aceites esenciales como eucaliptol, hinokitiol (procedentes de las cupresáceas), lactoferrinas y lactoperoxidasas presentes en la leche y otras secreciones exocrinas, han sido también propuestas como alternativas a las fórmulas tradicionales. No obstante, se precisan más estudios con diseños longitudinales a largo plazo para confirmar, con mayor evidencia, la eficacia antihalitosis de estos principios activos.
El empleo de los enjuagues orales ha demostrado ser eficaz para el control de la halitosis. No obstante, su uso no está exento de efectos adversos como tinciones de la mucosa oral, alteración del gusto, lesiones de la mucosa oral y sensación oral anómala. El abordaje terapéutico de la halitosis exige realizar un adecuado diagnóstico causal y en función de su origen, establecer un adecuado protocolo que puede implicar terapia periodontal (tartrectomía y/o raspado y alisado radicular), implementación de técnicas mecánicas de control de placa (cepillado dental, higiene interproximal y raspado lingual) y la prescripción de colutorios como terapia química coadyuvante.
Renvert S, Noack MJ, Lequart C, Roldán S, Laine ML. The underestimated problem of intra-oral halitosis in dental practice: an expert consensus review. Clin Cosmet Investig Dent. 2020;12:251–62.
Faria SFS, Costa FO, Silveira JO, Cyrino RM, Cota LOM. Self-reported halitosis in a sample of Brazilians: Prevalence, associated risk predictors and accuracy estimates with clinical diagnosis. J Clin Periodontol. 2020;47(2):233–46.
Silva MF, Leite FRM, Ferreira LB y cols. Estimated prevalence of halitosis: a systematic review and metaregression analysis. Clin Oral Investig. 2018;22(1):47–55.
Villa A, Zollanvari A, Alterovitz G, Cagetti MG, Strohmenger L, Abati S. Prevalence of halitosis in children considering oral hygiene, gender and age. Int J Dent Hyg. 2014;12(3):208–12.
Avcu N, Ozbek M, Kurtoglu D, Kurtoglu E, Kansu O, Kansu H. Oral findings and health status among hospitalized patients with physical disabilities, aged 60 or above. Arch Gerontol Geriatr. 2005;41(1):69–79.
Ren W, Xun Z, Wang Z, y cols. Tongue coating and the salivary microbial communities vary in children with halitosis. Nat Publ Gr [Internet]. 2016:1– 12.
Suzuki N, Yoneda M, Takeshita T, Hirofuji T, Hanioka T. Induction and inhibition of oral malodor. Mol Oral Microbiol. 2019; 34 (3):85–96.
Tangerman a, Winkel EG. Extra-oral halitosis: an overview. J Breath Res [Internet]. 2010;4(1):017003.
Fedorowicz Z, Aljufairi H, Nasser M, Tl O, Pedrazzi V. Mouthrinses for the treatment of halitosis ( Review ). Cochrane Database Syst Rev. 2008;(4).
Kuo Y-W, Yen M, Fetzer S, Lee J-D. Toothbrushing versus toothbrushing plus tongue cleaning in reducing halitosis and tongue coating: a systematic review and meta-analysis. Nurs Res. 2013;62(6):422–9.
Dwivedi V, Torwane NA, Tyagi S, Maran S. Effectiveness of various tongue cleaning aids in the reduction of tongue coating and bacterial load: a comparative clinical study. J Contemp Dent Pract. 2019;20(4):444–8.
Outhouse TL, Al-Alawi R, Fedorowicz Z, Keenan J V. Tongue scraping for treating halitosis. Cochrane database Syst Rev. 2006;(2):CD005519.
Hampelska K, Jaworska MM, Babalska ZŁ, Karpiński TM. The role of oral microbiota in intra-oral halitosis. J Clin Med. 2020;9(8).
Mendes L, Coimbra J, Pereira AL, Resende M, Pinto MG. Comparative effect of a new mouthrinse containing chlorhexidine, triclosan and zinc on volatile sulphur compounds: a randomized, crossover, double-blind study. Int J Dent Hyg. 2016;14(3):202–8.
Roldán S, Herrera D, Santa-Cruz I, O’Connor A, González I, Sanz M. Comparative effects of different chlorhexidine mouth-rinse formulations on volatile sulphur compounds and salivary bacterial counts. J Clin Periodontol. 2004;31(12):1128–34.
Young A, Jonski G, Rölla G. Combined effect of zinc ions and cationic antibacterial agents on intraoral volatile sulphur compounds (VSC). Int Dent J. 2003;53(4):237–42.
Slot DE, De Geest S, van der Weijden FA, Quirynen M. Treatment of oral malodour. Medium-term efficacy of mechanical and/ or chemical agents: a systematic review. J Clin Periodontol. 2015;42 Suppl 1:S303– 16.
Addy M, Moran JM. Clinical indications for the use of chemical adjuncts to plaque control: chlorhexidine formulations. Periodontol 2000. 1997;15:52–4.
Krautheim AB, Jermann THM, Bircher AJ. Chlorhexidine anaphylaxis: case report and review of the literature. Contact Dermatitis. 2004;50(3):113–6.
Pitts G, Brogdon C, Hu L, Masurat T, Pianotti R, Schumann P. Mechanism of action of an antiseptic, anti-odor mouthwash. J Dent Res. 1983;62(6):738– 42.
West NX, Addy M, Newcombe R, y cols. A randomised crossover trial to compare the potential of stannous fluoride and essential oil mouth rinses to induce tooth and tongue staining. Clin Oral Investig. 2012;16(3):821–6.
Silva MF de A, dos Santos NB, Stewart B, DeVizio W, Proskin HM. A clinical investigation of the efficacy of a commercial mouthrinse containing 0.05% cetylpyridinium chloride to control established dental plaque and gingivitis. J Clin Dent. 2009;20(2):55–61.
Bascones A, Morante S, Mateos L, Poblet J. Influence of additional active ingredients on the effectiveness of nonalcoholic randomized controlled trial. J Periodontol. 2005:1469–75.
Popkin DL, Zilka S, Dimaano M, y cols. Cetylpyridinium Chloride (CPC) exhibits potent, rapid activity against influenza viruses in vitro and in vivo. Pathog Immun. 2017;2(2):252–69.
Vergara-Buenaventura A, Castro-Ruiz C. Use of mouthwashes against COVID-19 in dentistry. Br J Oral Maxillofac Surg. 2020;58(8):924–7.
Levy CW, Roujeinikova A, Sedelnikova S, y cols. Molecular basis of triclosan activity. Vol. 398, Nature. England; 1999. p. 383– 4.
Addy M, Jenkins S, Newcombe R. Toothpastes containing 0.3% and 0.5% triclosan. II. Effects of single brushings on salivary bacterial counts. Am J Dent. 1989;2 Spec No:215–9.
Young A, Jonski G, Rölla G. A study of triclosan and its solubilizers as inhibitors of oral malodour. J Clin Periodontol. 2002;29(12):1078–81.
Tran DN, Jung E-M, Yoo Y-M, Lee J-H, Jeung E-B. Perinatal Exposure to Triclosan Results in Abnormal Brain Development and Behavior in Mice. Int J Mol Sci. 2020;21(11).
Xiang L, Rojo R, Prados-Frutos JC. Evaluation of the efficacy of Lacer Hali(TM) treatment on the management of halitosis: a randomized double-blind clinical trial. J Clin Med. 2020;10(11).
Blom T, Quirynen M. The effect of mouthrinses on oral malodor : a systematic review. Int J Dent Hyg. 2012;1–14.
Sheng J, Nguyen PTM, Marquis RE. Multi-target antimicrobial actions of zinc against oral anaerobes. Arch Oral Biol. 2005;50(8):747–57.
Young A, Jonski G, Rölla G. Inhibition of orally produced volatile sulfur compounds by zinc, chlorhexidine or cetylpyridinium chloride–effect of concentration. Eur J Oral Sci. 2003;111(5):400–4.
Wåler SM. The effect of some metal ions on volatile sulfur-containing compounds originating from the oral cavity. Acta Odontol Scand. 1997;55(4):261–4.
Quirynen M, Avontroodt P, Soers C, Zhao H, Pauwels M, Coucke W, et al. The efficacy of amine fluoride/stannous fluoride in the suppression of morning breath odour. J Clin Periodontol. 2002;29(10):944–54.
Prasad AS. Essential trace elements in human health and disease. J Am Coll Nutr. 1985;4(1):1–2.
Young A, Jonski G, Rölla G, Wåler SM. Effects of metal salts on the oral production of volatile sulfur-containing compounds (VSC). J Clin Periodontol. 2001;28(8):776–81.
Frascella J, Gilbert R, Fernandez P. Odor reduction potential of a chlorine dioxide mouthrinse. J Clin Dent. 1998;9(2):39–42.
Kim J-S, Park J-W, Kim D-J, Kim Y-K, Lee J-Y. Direct effect of chlorine dioxide, zinc chloride and chlorhexidine solution on the gaseous volatile sulfur compounds. Acta Odontol Scand. 2014;72(8):645–50.
Tombes MB, Gallucci B. The effects of hydrogen peroxide rinses on the normal oral mucosa. Nurs Res. 1993;42(6):332– 7.
Sharma K, Acharya S, Verma E, Singhal D, Singla N. Efficacy of chlorhexidine, hydrogen peroxide and tulsi extract mouthwash in reducing halitosis using spectrophotometric analysis: A randomized controlled trial. J Clin Exp Dent. 2019;11(5):e457–63.
Ortega KL, Rech BO, El Haje GLC, Gallo CB, Pérez-Sayáns M, Braz-Silva PH. Do hydrogen peroxide mouthwashes have a virucidal effect? A systematic review. J Hosp Infect. 2020;106(4):657–62.
Kumbargere Nagraj S, Eachempati P, Uma E, Singh VP, Ismail NM, Varghese E. Interventions for managing halitosis. Cochrane database Syst Rev. 2019;12(12):CD012213.

Xiang Zhou, LaiQi
Doctorando de Ciencias de la salud Universidad Rey Juan Carlos. Práctica privada en Halitosis y Odontología estética en Core Centro dental.
Rojo López, Rosa
Acreditada a la figura de profesor contratado doctor. Facultad de Odontología. Universidad Alfonso X el Sabio. Madrid.
Herrera Ureña, Luz
Profesora ayudante doctor. Facultad de Ciencias Biomédicas. Grado de Odontología, Universidad Europea de Madrid. Practica privada en Odontología Estética.
Cidoncha Cabrerizo, Gema
Doctora en Odontología. Profesora ayudante Grado de Odontología. Universidad Europea de Madrid. Practica privada en periodoncia e implantes.
Prados Frutos, Juan Carlos
Catedrático de Universidad. Grupo de Alto Rendimiento IDIBO (Innovación, Desarrollo e Investigación en Biomateriales en Odontología), Departamento de Especialidades Médicas y Salud Pública. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Madrid.