Artículo original
Freire Mancebo Y, Larrosa Pérez M, Esteban Martínez I, Palma White B, Cisneros Cabello, R. Cementos de silicato de calcio: evaluación de la toxicidad y de la respuesta inflamatoria. Cient. Dent. 2021; 18; 3; 145-152
Cementos de silicato de calcio: evaluación de la toxicidad y de la respuesta inflamatoria
La biocompatibilidad de los cementos selladores es una característica que debe tenerse en cuenta, ya que podría influir en el resultado del tratamiento de conductos. El objetivo de este estudio fue analizar la citotoxicidad de los cementos selladores a base de silicatos BioRoot® RCS y Nano-ceramic Sealer®, y el sellador a base de resina epóxica AH Plus Jet®, así como su respuesta inflamatoria asociada en fibroblastos humanos. Se seleccionaron 36 dientes unirradiculares, se instrumentaron y obturaron con los selladores seleccionados. A continuación, se pusieron en contacto con el medio de cultivo para obtener los medios acondicionados a las 24, 48 y 72 horas. Los medios acondicionados obtenidos fueron cultivados con la línea celular de fibroblastos L-132. La viabilidad de las células se evaluó mediante el ensayo del bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5 difenil tetrazolio (MTT). La respuesta inflamatoria se analizó mediante la medición de los niveles de IL-6 determinados a través del ensayo ELISA (ensayo por inmunoabsorción ligado a enzimas) y mediante los niveles de nitrito (ensayo de fluorescencia). Todos los selladores mostraron un cierto grado de citotoxicidad durante el tiempo de evaluación, mientras que sólo el BioRoot® RCS desencadenó una respuesta pro-inflamatoria. Es necesario seguir investigando para evaluar otros aspectos de la biocompatibilidad de los cementos selladores a base de silicato.
Biocompatibility of sealers is a feature to be taken into account as it might influence the outcome of the treatment. The aim of this study was to analyze the cytotoxicity of the silicate-based root canal sealers BioRoot™ RCS and Nanoceramic Sealer™and the epoxy-resin based sealer AH Plus Jet™, as well as their associated inflammatory response in human fibroblast. Thirty-six human teeth were selected, prepared, filled with the selected sealers and put in contact with culture medium to obtain extracts at 24, 48 and 72 hours. Then, the extracts were cultured with the L-132 fibroblast cell line. Cell viability was evaluated using the 3-(4,5-dimethylthiazol-2- yl)-2,5 diphenyl tetrazolium bromide (MTT) assay. Inflammatory response was analyzed by measuring IL-6 levels determined by ELISA and nitrite levels (fluorescence assay). All sealers showed a certain degree of cytotoxicity during the evaluation time, while only the BioRoot™ RCS triggered a pro-inflammatory response. Further research is needed to assess other aspects of biocompatibility of silicate-based root canal sealers.
En la actualidad, ninguno de los cementos de endodoncia presenta todas las características1 que un cemento ideal debería tener2 . Por lo tanto, los fabricantes tratan de mejorar constantemente estas propiedades, introduciendo nuevos cementos en el mercado3 . Dado que los cementos podrían llegar a los tejidos periodontales a través de las diferentes conexiones existentes, es importante conocer sus propiedades4 ya que podrían causar una respuesta5 . La biocompatibilidad es una de las características que podrían influir en el resultado del tratamiento endodóntico1 , y está determinada por diferentes aspectos, entre los que se incluye la citotoxicidad6 .
La citotoxicidad se define como la capacidad de un material para influir en la viabilidad celular7 y, en general, es el primer paso que se analiza al evaluar la biocompatibilidad8 . La Organización Internacional para la Normalización (ISO) sugiere la realización de ensayos de citotoxicidad “in vitro” al ser sencillos, controlables y reproducibles9 . Sin embargo, hay que tener en cuenta que la citotoxicidad sólo describe un aspecto de la biocompatibilidad7 . Otra posible respuesta, a los materiales potencialmente tóxicos, sería una reacción inflamatoria10. Se sabe que diferentes citoquinas proinflamatorias11, como la interleuquina (IL) y el factor de necrosis tumoral (TNF)12, participan en la respuesta inflamatoria contribuyendo al proceso de curación11.
Debido a las buenas propiedades de biocompatibilidad que presentan los cementos a base de silicato de calcio, recientemente se han desarrollado diferentes cementos selladores basados en dicho componente13-15, como el iRoot® SP, el BioRoot® RCS o el Nano-ceramic Sealer®. El BioRoot® RCS está compuesto por silicato tricálcico y polvo de óxido de circonio, que se mezcla con una solución acuosa a base de cloruro de calcio16,17, mientras que el cemento Nano-ceramic Sealer® está compuesto de silicatos de calcio, óxido de zirconio, agente espesante y rellenos15. Sin embargo, los cementos a base de resina epóxica se siguen utilizando de forma frecuente en los tratamientos de endodoncia18,19, siendo considerado el AH Plus® como el “gold standard”17,20,21.
El objetivo del presente estudio fue evaluar la citotoxicidad y la respuesta inflamatoria de los cementos a base de silicato de calcio Nano-ceramic Sealer® y el BioRoot® RCS, y compararlo con el cemento a base de resina AH Plus Jet®, en la línea celular de fibroblastos humanos L-132. Las hipótesis nulas planteadas establecieron que no se encontrarían diferencias entre los diferentes cementos, ni en términos de citotoxicidad ni en términos de respuesta inflamatoria.
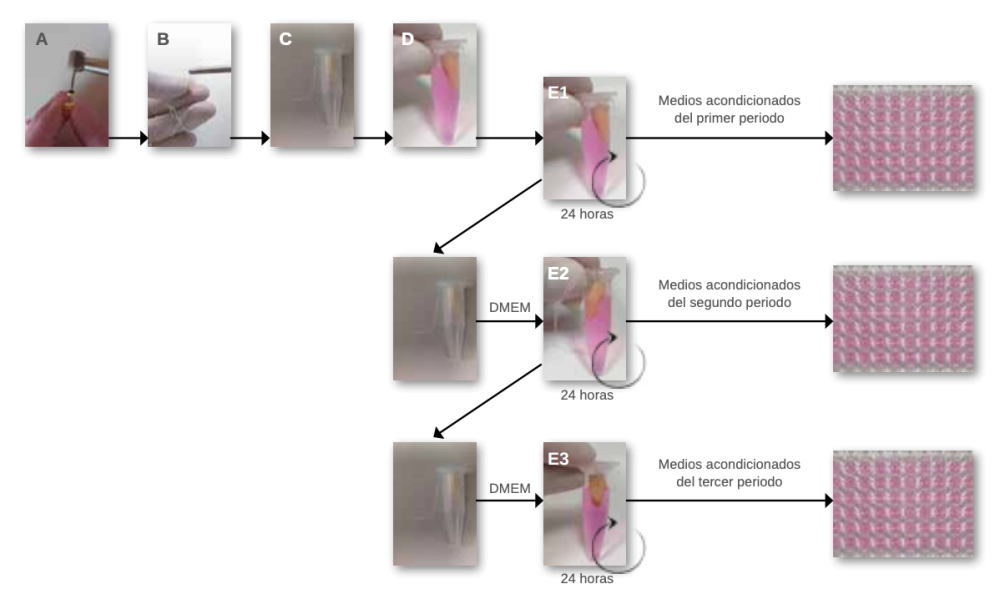
El presente estudio se basó en un contacto indirecto de los cementos y las células, basado en la técnica empleada por Camps y cols.,22 (Figura 1). Este estudio fue aprobado por el Comité de Ética de la Universidad Europea (Nº de referencia CIPI/19/139). Para ello, se seleccionaron 36 (N=36) incisivos centrales superiores humanos extraídos por razones periodontales. Se excluyeron aquellos que presentaron ápices abiertos, fisura, caries, reabsorciones, calcificaciones o tratamiento endodóntico previo. A continuación, se eliminó la corona a nivel apical de la unión amelocementaria mediante discos (0,25mm, Dynex Brillantmounted, Renfert Gmbh, Hilzingen, Alemania) montados en una pieza de mano (KaVo E10C 1:1, KaVo Dental, Biberach, Alemania). Durante el estudio, los dientes se almacenaron en tamón fosfato salino con antibiótico (100 U/ mL de estreptomicina y penicilina).
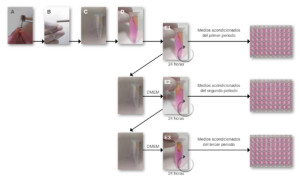
colocación de la porción apical de los dientes en contacto con el medio de cultivo DMEM (D); y obtención de los medios acondicionados
tras 24 horas de incubación de los diferentes periodos de evaluación, primer periodo 0-24 horas (E1), segundo periodo 24-48 horas (E2)
y tercer periodo 48-72 horas (E3).
Cultivo celular
Los fibroblastos L-132 se cultivaron en un medio de cultivo (Medio Eagle Modificado de Dulbecco (DMEM)) complementado con antibiótico (1% de penicilina y 1% de estreptomicina), 2mM L-glutamina y 10% de suero fetal bovino (SFB, Sigma-Aldrich, St. Louis, MO, EE.UU.). Las células se sembraron en placas de 96 pocillos a una densidad de 2500 células/cm2 cuando se cultivaron durante 24 y 48 horas, y a 2000 células/cm2 cuando se cultivaron durante 72 horas, en ambos casos a 37ºC en una atmósfera húmeda al 95% de aire y 5% de CO2 . El medio se renovó cada tres días y las células se subcultivaron cada semana en una proporción de 1 a 20 por tripsinización (0,25% Trypsin-EDTA).
Preparación de los dientes
Se confirmó la permeabilidad de los dientes, se fijó una longitud de trabajo a 0,5 mm del foramen con una lima K (ISO#10, Dentsply Maillefer, Tulsa, OK, USA) y se instrumentaron con limas Reciproc® R40 (VDW GmbH, Munich, Germany) montadas en el motor VDW Silver® Reciproc® (VDW GmbH, Munich, Germany) (Figura 1A). Durante la instrumentación, llevó a cabo la irrigación con agua destilada con antibiótico (estreptomicina, penicilina) seguida de una activación final con el sistema EndoActivator® (Dentsply Tulsa Dental Specialties, Tulsa, OK).
Contacto indirecto entre los fibroblastos L132 y los cementos
Los dientes fueron esterilizados durante 35 minutos a 105ºC en un autoclave22,23 y distribuidos aleatoriamente en tres grupos: grupo A, AH Plus Jet® (Dentsply DeTrey GmbH, Konstanz, Germany); grupo B, BioRoot® RCS (BR, Septodont, Saint-Maur-des-Fosses, France); y grupo C, Nano-ceramic Sealer® (B&L Biotech, Fairfax, VA, USA). Los cementos se prepararon en condiciones estériles, dentro de una campana de flujo laminar (Telstar Bio II Advance Plus®, Terrasa, España), siguiendo las instrucciones del fabricante. Una vez mezclados, se introdujeron en una jeringa de insulina de 1 ml (BD Plastipak®, BD™). 2µl de cada cemento se introdujeron en el conducto, llevando a cabo la obturación mediante la técnica de condensación lateral (Figura 1B). A continuación, los dientes preparados se introdujeron en un microtubo (Figura 1C) y se añadieron 1,2 ml de DMEM de tal manera que sólo las porciones apicales de los dientes estuviesen en contacto con el medio (Figura 1D).
Obtención de los medios acondicionados de los cementos
En este punto, se llevó a cabo una modificación del estudio de Camps y cols.,22. Tras 24 horas de incubación, se obtuvieron medios acondicionados del primer período (0-24 horas) (Figura 1E1). A continuación, los microtubos se rellenaron con 1.2 mL de DMEM. Tras las siguientes 24 de incubación, se obtuvieron los medios acondicionados del segundo periodo (24-48 horas) (Figura 1 E2). El proceso se repitió para obtener los medios acondicionados del tercer período (48-72 horas) (Figura 1 E3). Para reducir la variabilidad individual entre las muestras, los medios de cada cemento obtenidos en cada período se agruparon en tubos Falcon. La relación superficie/medio fue de 0,5 cm/mL, estando dentro de los límites de la ISO para este tipo de estudio23.
Evaluación de la citotoxicidad
Los 200 µL de DMEM de la placa de 96 pocillos sembrada con los fibroblastos fueron reemplazados por los medios acondicionados de los tres períodos e incubados durante 24 horas a 37ºC y 5% de CO2 . La viabilidad celular fue evaluada mediante el ensayo del bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5 difenil tetrazolio (MTT) (Sigma Chemical Company, St Louis, MO). Los medios acondicionados fueron retirados y reemplazados por MTT e incubados durante 4 horas a 37ºC y 5% de CO2 . Tras el periodo de incubación, se retiraron los sobrenadantes y se añadió dimetil sulfóxido a cada pocillo. La absorbancia se midió utilizando un lector de microplacas (SPECTROstar® Nano, Offenburg, Alemania) a 570 nm y 690 nm (para la muestra y el fondo, respectivamente). Los controles con el medio DMEM se tomaron como control positivo con 100% de biocompatibilidad.
Respuesta inflamatoria
Para determinar si la citotoxicidad de los cementos estaba mediada por un proceso inflamatorio, las células se sembraron en placas de 96 pocillos y se trataron con los medios acondicionados de los tres periodos evaluados. Como control positivo de la inflamación, las células fueron tratadas con TNF-α a una concentración de 10 ng/ mL. Tras 24 horas, se recogieron los sobrenadantes en los cuales, se determinaron los niveles de IL-6 mediante ELISA (Peprotech, Rocky Hill, NJ, EE.UU.) y los niveles de nitrito, como medida indirecta de la liberación de óxido nítrico al medio de cultivo, mediante el protocolo descrito por Nussler y cols.,24.
Análisis estadístico
Para realizar el análisis estadístico, se utilizó el software SPSS 22.0 (IBM Corp, ArmonK, NY, EE.UU.). Se determinaron como variables los cementos y el tiempo. Se utilizó el análisis de la varianza (ANOVA) bifactorial para evaluar la citotoxicidad de los tres cementos en los tres períodos. Se utilizó la prueba de Bonferroni para las comparaciones post-hoc. La significación estadística se estableció para valores de p ≤ 0,05.
Evaluación de la citotoxicidad
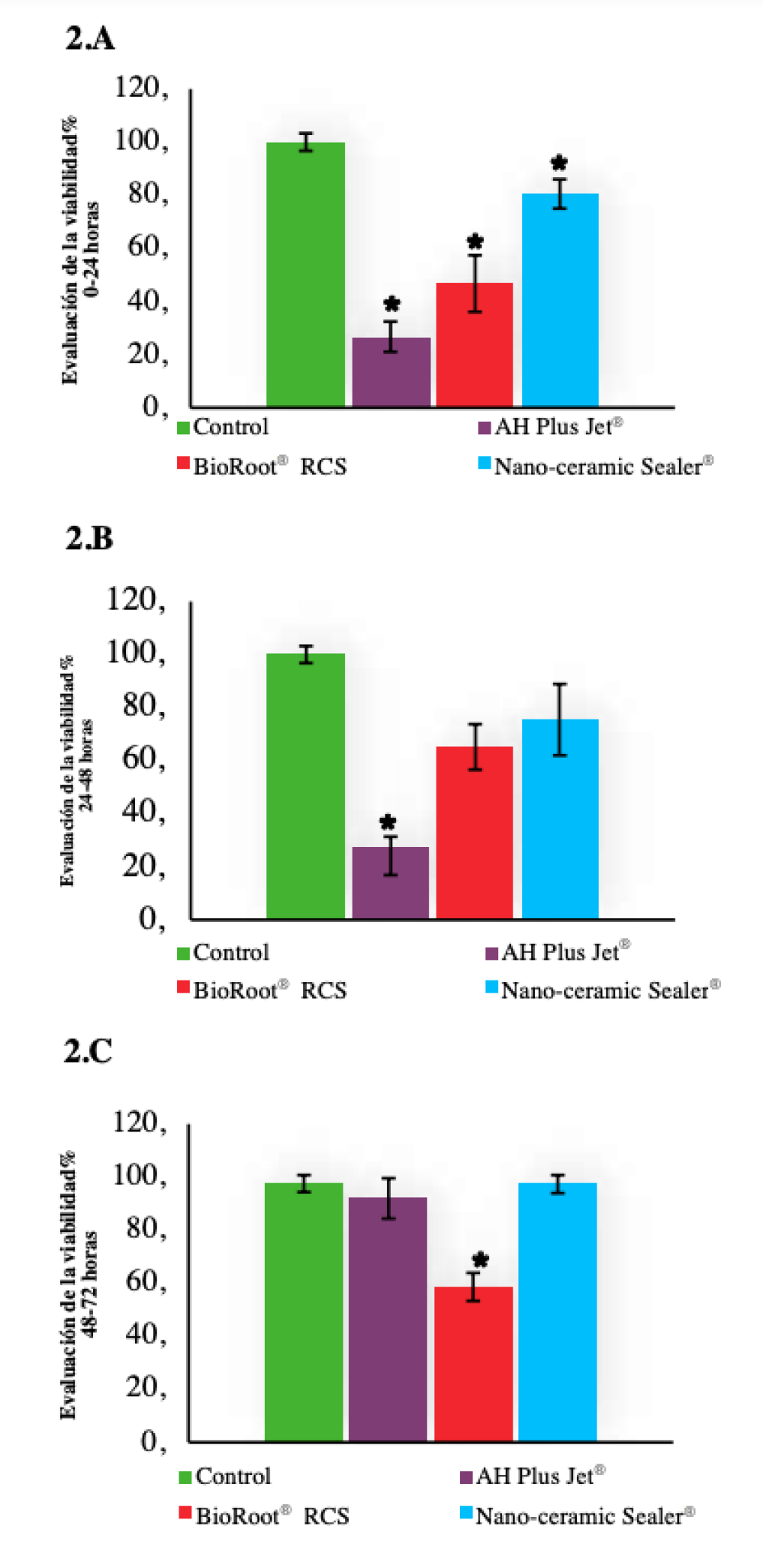
Los resultados indican que todos los cementos presentaron algún grado de toxicidad con una tendencia decreciente a lo largo del tiempo (Figura 2). El ANOVA bifactorial reveló diferencias significativas para cada período entre los cementos. En el primer período, el Nano-ceramic Sealer® presentó el nivel más bajo de citotoxicidad (P<0,005). En el segundo período, el AH Plus Jet® presentó los niveles más altos de citotoxicidad (P<0,008), mientras que en el tercer período de evaluación (48-72 horas) sólo el grupo BioRoot® RCS presentó una ligera toxicidad (P<0,001).
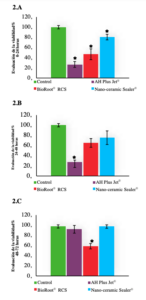
Respuesta inflamatoria
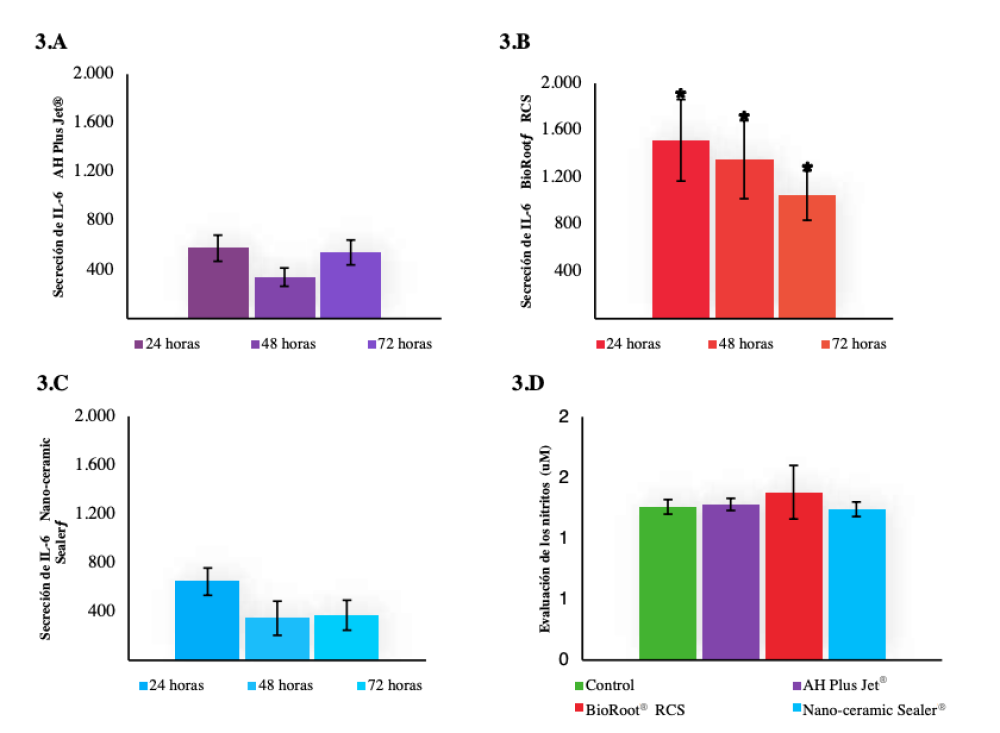
Los resultados mostraron que ni el AH Plus Jet® ni el Nano-ceramic Sealer® indujeron un proceso inflamatorio, mientras que el grupo BioRoot® RCS presentó un ligero aumento de los niveles de IL-6 en el entorno celular en los tres tiempos de evaluación (Figura 3). En cuanto a los niveles de nitrito, no se detectaron aumentos en el medio, ni siquiera cuando las células fueron estimuladas con TNF-α (Figura 3).
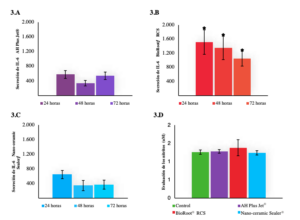
evaluación (24, 48 y 72 horas). Análisis de los nitritos a las 24 (3.D). *Diferencias estadísticamente significativas.
En el presente estudio se analizó la respuesta de los fibroblastos L-132 a los cementos a base de silicatos BioRoot® RCS y Nano-ceramic Sealer®, comparándolos con el cemento de resina AH Plus Jet®. Los resultados rechazaron la hipótesis nula para el análisis de la citotoxicidad y rechazaron de forma parcial la hipótesis nula para la respuesta inflamatoria. Al evaluar la citotoxicidad en los distintos períodos y la IL-6, se observaron diferencias significativas entre los cementos, sin embargo, no se observaron diferencias entre las respuestas inflamatorias con respecto al análisis de los nitritos.
Aunque los cementos sólo deben utilizarse en el interior de los conductos12, algunos de sus componentes podrían llegar a los tejidos periapicales17. El modelo seleccionado para el presente estudio se basó en la “técnica de inmersión en la raíz”22, ya que reduce la sobreexposición del sellador al medio23 permitiendo una reproducción más realista de las condiciones “in vivo”. Sin embargo, se aplicó una modificación menor debido al hecho de que los tejidos periapicales están en contacto con fluidos extracelulares, lo que disminuye la concentración del sellador25. Por lo tanto, a la hora de comparar resultados, se debe tener en cuenta que las diferentes metodologías utilizadas en los ensayos de citotoxicidad, como el tipo de célula empleada20,26 o el modelo utilizado20, podría influir en los resultados. Hay que tener en cuenta, que los estudios “in vitro” no reproducen las condiciones dinámicas de los tejidos periapicales27, por lo que se requieren nuevas investigaciones con modelos más complejos.
En el presente estudio, los medios acondicionados se comenzaron a recoger con los cementos recién mezclados. La evaluación de los selladores recién mezclados simula las condiciones clínicas25 y permite la evaluación de los selladores durante el tiempo de fraguado, durante el cual, se podrían liberar subproductos17. Taraslia y cols.,27 observaron en su estudio que la citotoxicidad fue significativamente superior grupos recién mezclados. Sin embargo, otros estudios analizan los cementos una vez han fraguado22.
En relación con el análisis de la toxicidad, todos los selladores presentaron una toxicidad decreciente durante los diferentes periodos de evaluación, lo que coincide con los resultados de los estudios anteriores para BioRoot® RCS, Nano-ceramic Sealer®15 y para AH Plus® 28,29. Sin embargo, otras investigaciones mostraron un aumento de la citotoxicidad para BioRoot® RCS 30,31 y AH Plus®30-33.
Tras el análisis de las primeras 24 horas, el cemento Nano-ceramic Sealer® presentó mejor viabilidad celular. No se observaron diferencias entre AH Plus Jet® y BioRoot® RCS. Sin embargo, en otros estudios observaron mayor viabilidad para BioRoot® RCS que para el Nano-ceramic Sealer®15 y menos citotoxicidad para el BioRoot® RCS que para los cementos de resina17,34. A las 48 horas, algunos estudios obtuvieron valores de viabilidad más bajos para BioRoot® RCS que para el grupo control17,22. Finalmente, después de 72 horas, sólo el BioRoot® RCS presentó una ligera citotoxicidad. Sin embargo, Dimitrova-Nakov y cols.,14 no observaron ninguna diferencia en la viabilidad entre el BioRoot® RCS y el grupo de control.
La presencia de ciertos niveles de citotoxicidad podría depender de la solubilidad de los cementos35. Zhang y cols.36 observaron en cementos a base de silicato, que una ligera respuesta citotóxica del sellador iRoot® SP podría estar relacionada con el elevado pH de la superficie que causa la desnaturalización de las proteínas y células adyacentes. En relación con los cementos de resina, una mínima liberación de formaldehído que puede ser causada por las aminas de su composición, podría ser responsable de la presencia de una toxicidad inicial17.
En la literatura se han descrito reacciones inflamatorias transitorias al entrar en contacto el cemento sellador con los tejidos periapicales37. Sin embargo, la interacción entre los cementos y las células que participan en la curación de los tejidos no es muy conocida38. En presencia de cuerpos extraños, se reclutan diferentes líneas celulares como macrófagos derivados de monocitos, neutrófilos o linfocitos39. Estas células promueven el proceso inflamatorio, secretando factores de crecimiento y citoquinas39 como IL-1, IL-6, IL-8, prostaglandina E2 (PGE2 ) y óxido nítrico (NO)11. Además, las citoquinas también se expresan durante la infección bacteriana de la pulpa40.
En relación con el análisis de la respuesta inflamatoria, en el presente trabajo se midió la citoquina inflamatoria IL-6 mediante el ensayo ELISA y los niveles de nitrito. El grupo BioRoot® RCS mostró una expresión de IL-6 en fibroblastos L132 a las 24, 48 y 72 horas, que disminuyó a lo largo del período de evaluación. En los cementos Nano-ceramic Sealer® y AH Plus Jet®, no se observó en ningún momento expresión de IL-6. Hay pocos estudios que evalúen la respuesta inflamatoria de los nuevos cementos de endodoncia a base de silicato. Jeanneau y cols.41 obtuvieron tras la estimulación de los fibroblastos, una disminución de la secreción de IL-6 con el BioRoot® RCS, pero un aumento de la secreción con el Pulp Canal Sealer. Los tres cementos presentaron una ausencia de niveles de nitrito, lo que elimina una posible fuente de inflamación, ya que las altas concentraciones pueden ser protóxicas e inflamatorias42.
El ligero aumento en los niveles de IL-6 que presentó el BioRoot® RCS, unido a la ligera citotoxicidad, podría desencadenar un proceso inflamatorio que podría ser positivo para el proceso de curación40. Se necesitarían más estudios para evaluar otros aspectos del proceso inflamatorio, así como su evolución a lo largo del tiempo.
Todos los cementos selladores mostraron un cierto nivel de citotoxicidad, que disminuyó durante el periodo de evaluación. El cemento BioRoot® RCS fue el único que mantuvo un ligero nivel de citotoxicidad a las 72h de incubación y el único que desencadenó una respuesta inflamatoria. Se necesitan más estudios para evaluar la respuesta celular a los diferentes cementos a base de silicatos.
Agradecemos a la Universidad Europea el apoyo financiero de la investigación.
Zhou HM, Du TF, Shen Y, Wang ZJ, Zheng YF, Haapasalo M. In vitro cytotoxicity of calcium silicate-containing endodontic sealers. J Endod 2015;41(1):56-61.
Lucena-Martín C, Ferrer-Luque CM, González-Rodríguez MP, RoblesGijón V, Navajas-Rodrguez MJM. A Comparative Study of Apical Leakage of Endomethasone, Top Seal, and Roeko Seal Sealer Cements. J Endod 2002;28(6):423-6.
Corral Nunez CM, Bosomworth HJ, Field C, Whitworth JM, Valentine RA. Biodentine and mineral trioxide aggregate induce similar cellular responses in a fibroblast cell line. J Endod 2014;40(3):406-11.
Huang TH, Lii CK, Chou MY, Kao CT. Lactate Dehydrogenase Leakage of Hepatocytes with AH26 and AH Plus Sealer Treatments. J Endod 2000;26(9):509-11.
Sousa CJ, Montes CR, Pascon EA, Loyola AM, Versiani MA. Comparison of the intraosseous biocompatibility of AH Plus, EndoREZ, and Epiphany root canal sealers. J Endod 2006;32(7):656-62.
Silva-Herzog D, Ramirez T, Mora J, Pozos AJ, Silva LA, Silva RA, et al. Preliminary study of the inflammatory response to subcutaneous implantation of three root canal sealers. Int Endod J 2011;44(5):440-6.
Peters OA. Research that matters – biocompatibility and cytotoxicity screening. Int Endod J 2013;46(3):195-7.
Tai KB, Huang FM, Chang YC. Cytotoxic Evaluation of Root Canal Filling Materials on Primary Human Oral Fibroblast Cultures and a Permanent Hamster Cell Line. J Endod 2001;27(9):571-3.
Scelza MZ, Linhares AB, da Silva LE, Granjeiro JM, Alves GG. A multiparametric assay to compare the cytotoxicity of endodontic sealers with primary human osteoblasts. Int Endod J 2012;45(1):12-8.
D. ÖM, Yilmaz S, Kalayci A, Zaimalu L. A comparison of the in vitro cytotoxicity of two root canal sealers. J Oral Rehabil 2003;30:426-9.
Chang SW, Lee SY, Kum KY, Kim EC. Effects of ProRoot MTA, Bioaggregate, and Micromega MTA on odontoblastic differentiation in human dental pulp cells. J Endod 2014;40(1):113-8.
Diomede F, Caputi S, Merciaro I, Frisone S, D’Arcangelo C, Piattelli A y cols. Proinflammatory cytokine release and cell growth inhibition in primary human oral cells after exposure to endodontic sealer. Int Endod J 2014;47(9):864-72.
Donnermeyer D, Bürklein S, Dammaschke T, Schäfer E. Endodontic sealers based on calcium silicates: a systematic review. Odontology 2018 2019;107(4):421-436.
Dimitrova-Nakov S, Uzunoglu E, Ardila-Osorio H, Baudry A, Richard G, Kellermann O y cols. In vitro bioactivity of Bioroot RCS, via A4 mouse pulpal stem cells. Dent Mater 2015;31(11):1290-7.
Collado-Gonzalez M, Garcia-Bernal D, Onate-Sanchez RE, Ortolani-Seltenerich PS, Lozano A, Forner L y cols. Biocompatibility of three new calcium silicate-based endodontic sealers on human periodontal ligament stem cells. Int Endod J 2017;50(9):875-84.
Khalil I, Naaman A, Camilleri J. Properties of Tricalcium Silicate Sealers. J Endod. 2016;42(10):1529-35.
Alsubait SA, Al Ajlan R, Mitwalli H, Aburaisi N, Mahmood A, Muthurangan M y cols. Cytotoxicity of Different Concentrations of Three Root Canal Sealers on Human Mesenchymal Stem Cells. Biomolecules. 2018;8(3). pii: E68
Ersahan S, Aydin C. Dislocation resistance of iRoot SP, a calcium silicatebased sealer, from radicular dentine. J Endod 2010;36(12):2000-2.
Troiano G, Perrone D, Dioguardi M, Buonavoglia A, Ardito F, Lo Muzio L. In vitro evaluation of the cytotoxic activity of three epoxy resin-based endodontic sealers. Dent Mater J 2018;37(3):374-8.
Cintra LTA, Benetti F, de Azevedo Queiroz IO, Ferreira LL, Massunari L, Bueno CRE y cols. Evaluation of the Cytotoxicity and Biocompatibility of New Resin Epoxy-based Endodontic Sealer Containing Calcium Hydroxide. J Endod 2017;43(12):2088-92.
Silva Almeida LH, Moraes RR, Morgental RD, Pappen FG. Are Premixed Calcium Silicate-based Endodontic Sealers Comparable to Conventional Materials? A Systematic Review of In Vitro Studies. J Endod 2017;43(4):527-35.
Camps J, Jeanneau C, El Ayachi I, Laurent P, About I. Bioactivity of a Calcium Silicate-based Endodontic Cement (BioRoot RCS): Interactions with Human Periodontal Ligament Cells In Vitro. J Endod 2015;41(9):1469-73.
Camps J, About I. Cytotoxicity testing of endodontic sealers: a new method. J Endod 2003;29(9):583-6.
Nussler A, Konig S, Ott M, Sokal E, Christ B, Thasler W y cols. Present status and perspectives of cell-based therapies for liver diseases. J Hepatol 2006;45(1):144- 59.
Rodrigues C, Costa-Rodrigues J, Capelas JA, Fernandes MH. Longterm dose- and time-dependent effects of endodontic sealers in human in vitro osteoclastogenesis. J Endod 2013;39(6):833-8.
Miletic I, Devcic N, Anic I, Borcic J, Karlovic Z, Osmak M. The Cytotoxicity of RoekoSeal and AH Plus Compared during Different Setting Periods. J Endod. 2005;31(4):307-9.
Taraslia V, Anastasiadou E, Lignou C, Keratiotis G, Agrafioti A, Kontakiotis EG. Assessment of cell viability in four novel endodontic sealers. Eur J Dent 2018;12(2):287-91.
Azar NG, Heidari M, Bahrami ZS, Shokri F. In vitro cytotoxicity of a new epoxy resin root canal sealer. J Endod 2000;26(8):462-5.
Huang FM, Tai KW, Chou MY, Chang YC. Cytotoxicity of resin-, zinc oxide– eugenol-, and calcium hydroxide-based root canal sealers on human periodontal ligament cells and permanent V79 cells. Int Endod J 2002;35:153.
Poggio C, Riva P, Chiesa M, Colombo M, Pietrocola G. Comparative cytotoxicity evaluation of eight root canal sealers. J Clin Exp Dent 2017;9(4):e574-e8.
Colombo M, Poggio C, Dagna A, Meravini MV, Riva P, Trovati F y cols. Biological and physico-chemical properties of new root canal sealers. J Clin Exp Dent 2018;10(2): e120-e6.
Bouillaguet S, Wataha JC, Tay FR, Brackett MG, Lockwood PE. Initial in vitro biological response to contemporary endodontic sealers. J Endod 2006;32(10):989-92.
Cotti E, Petreucic V, Re D, Simbula G. Cytotoxicity evaluation of a new resinbased hybrid root canal sealer: an in vitro study. J Endod 2014;40(1):124-8.
Vouzara T, Dimosiari G, Koulaouzidou EA, Economides N. Cytotoxicity of a New Calcium Silicate Endodontic Sealer. J Endod 2018;44(5):849-52.
Jung S, Sielker S, Hanisch MR, Libricht V, Schafer E, Dammaschke T. Cytotoxic effects of four different root canal sealers on human osteoblasts. PLoS One. 2018;13(3): e0194467.
Zhang W, Li Z, Peng B. Ex vivo cytotoxicity of a new calcium silicatebased canal filling material. Int Endod J 2010;43(9):769-74.
Van Landuyt KL, Geebelen B, Shehata M, Furche SL, Durner J y cols. No evidence for DNA double-strand breaks caused by endodontic sealers. J Endod 2012;38:636-641.
Shon WJ, Bae KS, Baek SH, Kum KY, Han AR, Lee WC. Effects of calcium phosphate endodontic sealers on the behavior of human periodontal ligament fibroblasts and MG63 osteoblast-like cells. J Biomed Mater Res B Appl Biomater 2012;100(8):2141-7.
Schutte RJ, Xie L, Klitzman B, Reichert WM. In vivo cytokine-associated responses to biomaterials. Biomaterials 2009;30(2):160-8.
Balto K, Sasaki H, Stashenko P. Interleukin-6 deficiency increases inflammatory bone destruction. Infect Immun 2001;69(2):744-50.
Jeanneau C, Giraud T, Laurent P, About I. BioRoot RCS Extracts Modulate the Early Mechanisms of Periodontal Inflammation and Regeneration. J Endod 2019;45(8):1016-1023.
Silva PT, Pappen FG, Souza EM, Dias JE, Bonetti Filho I, Carlos IZ y cols. Cytotoxicity Evaluation of Four Endodontic Sealers. Braz Dent J 2008;19(3):228-31.

Freire Mancebo, Yolanda
Profesora ayudante del Departamento de Odontología pre-clínica de la Universidad Europea.
Larrosa Pérez, Mar
MASMicrobiota Group. Profesora titular de Biotecnología Alimentaria de la Universidad Europea. Beca del programa Ramón y Cajal (2012_11910) del Ministerio de Economía y Competitividad, España.
Esteban Martínez, Isabel
MASMicrobiota Group. Facultad de Ciencias de la Salud de la Universidad Europea.
Palma White, Beatriz
Máster de Endodoncia Avanzada de la Universidad Europea.
Cisneros Cabello, Rafael
Catedrático del Departamento de Odontología Clínica y director del Máster de Endodoncia Avanzada de la Universidad Europea.